Лучевая терапия при раке простаты: обзор методики
Планирование процедуры
Еще сравнительно недавно злокачественные образования предстательной железы не поддавались эффективному лечению. Единственным действенным методом было полное удаление простаты – простатэктомия.
 Развитие онкологической опухоли в простате постепенно приводит к блокированию функций репродуктивной системы мужчины
Развитие онкологической опухоли в простате постепенно приводит к блокированию функций репродуктивной системы мужчины
На сегодняшний день хирургические вмешательства постепенно вытесняются методикам радиационного облучения. К их преимуществам специалисты относят:
- более высокий уровень десятилетней выживаемости пациентов — до 85%;
- низкая (по сравнению с простатэктомией) вероятность возникновения послеоперационных осложнений.
Основными факторами, которые учитываются при планировании лечения путем радиационного облучения, валяются:
- стадия развития онкологического заболевания;
- индекс Глиссона;
- уровень ПСА;
- вероятность возникновения побочных эффектов;
- ожидаемая продолжительность жизни.
 Лучевая терапия при раке предстательной железы – один из способов сохранения жизни больному
Лучевая терапия при раке предстательной железы – один из способов сохранения жизни больному
Механизм действия
Чтобы в полной мере оценить возможную эффективность методики, нужно разобраться, что такое облучение при раке предстательной железы. Воздействие обычно проводится по следующей схеме:
- Для точного определения участка, на который будет осуществляться воздействия, делают компьютерную томографию. При этом выделяют так называемой терапевтический объем ткани, который будет подвергаться облучению: к нему относят не только пораженные участки простаты, но и прилегающие к ним здоровые клетки.
- После определения участка воздействия пораженные ткани подвергают радиационному облучению (гамма-излучение, рентгеновское излучение, бомбардировка протонами). При этом разовая доза облучения подбирается с таким расчетом, чтобы клетки злокачественных образований были максимально повреждены.
- При радиационном воздействии в клетках образуются свободные радикалы и пероксид водорода. В результате нарушается целостность клеточных мембран и разрушаются нуклеиновые кислоты (ДНК).
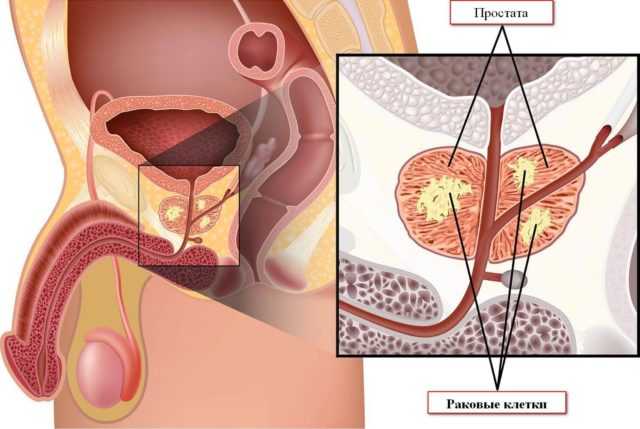 Если форма онкологии простаты неоперабельна, то единственным выходом избавиться от злокачественной патологии в железе является лучевая терапия
Если форма онкологии простаты неоперабельна, то единственным выходом избавиться от злокачественной патологии в железе является лучевая терапия
Разновидности радиотерапии
Если в качестве основного метода терапии было выбрано облучение — рак предстательной железы может подвергаться воздействию по нескольким методикам:
- Дистанционная терапия – самый распространённый метод радиационного лечения онкологических заболеваний. Сегодня чаще всего используется вместе с компьютерной томографией, помогающей максимально точно локализовать место воздействия. При дистанционной лучевой терапии процедура проводится точно по методике, описанной выше: опухоль облучается с помощью аппарата: при этом концентрированный поток излучения направляется на кожу пациента максимально близко к предстательной железе.
- Контактная терапия – усовершенствованная методика, позволяющая уменьшить вероятность поражения примыкающих к опухоли здоровых тканей. При контактной терапии источник излучения вводится в прямую кишку, после чего воздействие на простату осуществляется из точки, максимально близко к ней расположенной. Контактное облучение при раке предстательной железы мене травматично и реже провоцирует осложнения.
- Брахитерапия — позволяет воздействовать только на опухолевую ткань, сведя к минимуму риск радиационного поражения здоровых клеток. При терапевтическом воздействие в опухоль ввозят специальные капсулы, содержащие радиоактивный материал (йод–125). Период полураспада этого вещества составляет около 60 суток, что и определяет продолжительность воздействия.
 Первый вариант лечения онкологии простаты предусматривает внешнее влияние радиоактивных лучей на злокачественное уплотнение
Первый вариант лечения онкологии простаты предусматривает внешнее влияние радиоактивных лучей на злокачественное уплотнение
Есть отличия и по форме воздействия:
- терапия с модулированием интенсивности – осуществляется под контролем компьютерной программы, разделяющей поток излучаемых частиц на несколько разнонаправленных пучков;
- протонная терапия – позволяет минимизировать вред, наносимый здоровым тканям;
- нейтронная терапия — достаточно агрессивна, но демонстрирует эффективность, если новообразования не разрушаются под воздействием протоном либо гамма-лучей.
Как лечить рецидив
Радикальный метод не всегда нужен и подходит
Современная медицина предлагает несколько методов лечения злокачественной опухоли в предстательной железе. При таком заболевании нередко врачами предлагается оперативное вмешательство, которое позволяет удалить раковое новообразование. Но операция не во всех случаях эффективна, так как после нее в организме больного могут оставаться патогенные клетки.
После проведения лечения злокачественные клетки, оставшиеся в организме, начинают активизироваться и распространяться. Чтобы своевременно выявить данный процесс, требуется регулярно обследоваться у онколога. Лечащий врач изучит картину болезни пациента и предложит ему оптимальный вариант лечения, который, по его мнению, будет иметь благоприятный исход.
Облучение
Одним из востребованных способов лечения рецидивирующего рака простаты является лучевая терапия. Перед ее проведением пациент должен пройти тщательное обследование всего организма. Имеет смысл предлагать данный вариант терапии лишь в случае, если рак имеет локализованный характер и отсутствуют метастазы. В противном случае он не будет особо полезен больному.
При рецидиве шансы на выздоровление при помощи лучевой терапии ниже, чем при лечении таким методом онкологии при первом проявлении.
Не все раковые клетки поддаются облучению. Часть из них может оставаться в первоначальном состоянии и продолжать распространяться за пределы пораженной предстательной железы. Именно поэтому лучевая терапия не особо эффективна при лечении рецидива онкологического заболевания.
Гормонотерапия

Гормонотерапия является сопутствующим способом борьбы с недугом, а не основным
Гормональная терапия практикуется в клиниках, в которых занимаются лечением онкологических заболеваний. К такому методу прибегают после проведения биохимического курса.
В процессе проведения лечебных мероприятий в организме больного значительно снижается количество тестостерона. Именно этот гормон способствует активному разрастанию злокачественной опухоли.
Онкологи не раз говорили о том, что гормональное лечение не помогает полностью избавиться от рака и его рецидива. Это лишь вспомогательная мера, которая усиливает действие других терапевтических методик, направленных на борьбу со злокачественным новообразованием в предстательной железе.
Химиотерапия
Химиотерапия обычно назначается больным, у которых биохимический или другой тип рецидива рака простаты после выявления низкой эффективности гормонального лечения. Такие меры требуются в случае, если уровень тестостерона так и не удалось понизить.
Благодаря химиотерапии состояние пациента значительно улучшается за счет облегчения болезненной симптоматики.
HIFU-терапия
Рецидив у мужчины может случиться после полного удаления предстательной железы, которая была поражена раком. В такой ситуации выходом из положения становится HIFU-терапия. Основное действие лечебного метода направлено на разрушение злокачественных клеток путем влияния на них высокосфокусированного ультразвука.
Терапия имеет ряд существенных преимуществ, которые делают данный метод лечения востребованным и эффективным. Она позволяет безболезненно справиться с рецидивирующим раком и при этом не приводит к опасным осложнениям.
Любой из существующих методов борьбы с таким заболеванием, как биохимический или другой рецидив рака предстательной железы, не дает стопроцентную гарантию купирования развития злокачественных процессов в организме мужчины. Результат терапии будет напрямую зависеть от ряда факторов, которые в момент борьбы с опухолью влияют на общее состояние пациента.
Классификация
На сегодняшний момент в арсенале онкологов имеется несколько видов подобной терапии:
- брахитерапия;
- дистанционная;
- протонная;
- контактная.
После определения точной локализации и размеров ракового очага – с помощью КТ, МРТ диагностики, специалисты чаще всего задействуют дистанционный вариант облечения. Важнейшая цель – сохранить целостность окружающих очаг органов и тканей, еще не затронутых мутацией.
Процедуры, как правило, проводятся в поликлинических условиях. Продолжительность одного лечебного курса не менее 7.5–8 недель. После чего осуществляется анализ состояния здоровья пациента, выполняется перерыв – для восстановления здоровых тканей.
Из основных преимуществ дистанционного облучения можно указать:
- минимизированный риск тяжелых последствий и осложнений;
- возможность проведения процедур в амбулаторных условиях;
- превосходная переносимость пациентами.
Однако, имеются и недостатки, заставляющие специалистов испытывать сомнения в целесообразности подобной терапии:
- высокий риск поражения радиацией соседствующих с простатой органов и систем;
- формирование лучевых язвенных дефектов;
- возможный сбой в системе свертывания крови.
Последнее слово всегда остается за лечащим врачом – после тщательного анализа всей информации от предварительных диагностических процедур, им принимается решение о проведении либо отказе от дистанционного облучения.
Брахитерапия

Это еще одна распространенная и высокоэффективная методика лучевой терапии. Имеет минимальную степень травматизма окружающих простату органов.
После выявления структуры и размеров ракового очага, осуществляется установка в него радиоактивного компонента – распространение радиации на окружающие органы и ткани сведено к минимуму. На сегодняшний момент может применяться внутриполостная, внутрисосудистая, либо внутритканевая брахитерапия.
Проводиться может временная брахитерапия – в железу вводится полая игла, которая затем заполняется радиоактивной жидкостью. Через 5–12 минут игла удаляется, а оставшаяся жидкость вступает в тесный контакт с мутировавшими элементами органа. На протяжении 3.5–4 суток выполняется несколько подобных манипуляций.
Из преимуществ методики указываются:
- высокая выживаемость – до 75–80%;
- несомненная эффективность;
- минимальный риск формирования последствий;
- короткий период реабилитации;
- вернуться домой можно уже на следующие сутки после окончания процедур.
К возможным недостаткам методики относят:
- появление дизурических расстройств;
- при мочеиспускании может беспокоить не слишком интенсивное жжение;
- недержание урины либо некоторая затрудненность с мочеиспусканием;
- реже – кровотечение из ануса.
Назначение брахитерапии – удел высококвалифицированного специалиста. Акцентируется факт, что подобная процедура – превосходная альтернатива простатэктомии, ранее считавшейся единственным методом борьбы с раковым поражением органа.
На данный момент этот метод лечения еще далек от совершенства, потому ведутся новые разработки и внедряются передовые способы доставки ионизирующего излучения внутрь опухоли.
Методы облучения
Существует два новейших метода облучения тканей: конформный и с модулированной интенсивностью.
Лучевая терапия при раке предстательной железы может проводиться без контакта с телом пациента, а может выполняться и с введением источника излучения в полости, а также непосредственно в ткань предстательной железы больного. В зависимости от этого различают следующие виды лучевой терапии простаты:
- Дистанционная (облучение при раке простаты проводится аппаратом, расположенным на некотором расстоянии от тела пациента).
- Контактная (источник излучения вводится в полость, например в прямую кишку, где осуществляется контакт с тканями, непосредственно прилегающими к опухоли предстательной железы).
- Брахитерапия (игловидные и нитевидные источники помещаются непосредственно в ткань предстательной железы).
Виды лучевой терапии при раке простаты
Лучевая терапия РПЖ может быть назначена в качестве альтернативы хирургическому лечению. По эффективности она зачастую не уступает операции. Другие показания:
- В сочетании с гормональной терапией при раке, который распространился за пределы предстательной железы.
- При рецидиве рака.
- В качестве паллиативного лечения на поздних стадиях. Это помогает сдержать рост опухоли и увеличить продолжительность жизни пациента.

При раке простаты применяют два вида лучевой терапии: дистанционную (внешнюю) и внутритканевую лучевую терапию (брахитерапию).
Дистанционная лучевая терапия
Наиболее распространенный способ дистанционной лучевой терапии рака предстательной железы – фотонное облучение. Суммарная очаговая доза составляет 65-70 Гр, на тазовые лимфатические узлы – 45-50 Гр (при низком риске метастазирования не проводится), а разовая доза облучения – 1,8-2,0 Гр.
Внешнее облучение бывает разных видов:
- Трехмерная конформная лучевая терапия использует компьютерные технологии, чтобы определить точное местоположение предстательной железы и опухоли. Это помогает уменьшить повреждение окружающих здоровых тканей.
- Интенсивно-модулированная лучевая терапия — более совершенная разновидность 3D-конформной лучевой терапии. Аппарат не только облучает опухоль под разными углами, но и регулирует интенсивность излучения. Это позволяет подавать на простату еще большую дозу, избегая облучения здоровых тканей.
- Стереотаксическая терапия использует современные технологии, чтобы доставить всю дозу излучения туда, где находится злокачественная опухоль. Она позволяет сократить курс лучевой терапии, в итоге он продолжается дни вместо недель.
К преимуществам дистанционной лучевой терапии рака простаты относится то, что возможно полное излечение заболевания, не требуется госпитализация – лечение может быть проведено амбулаторно, а также оно позволяет избежать хирургического вмешательства.
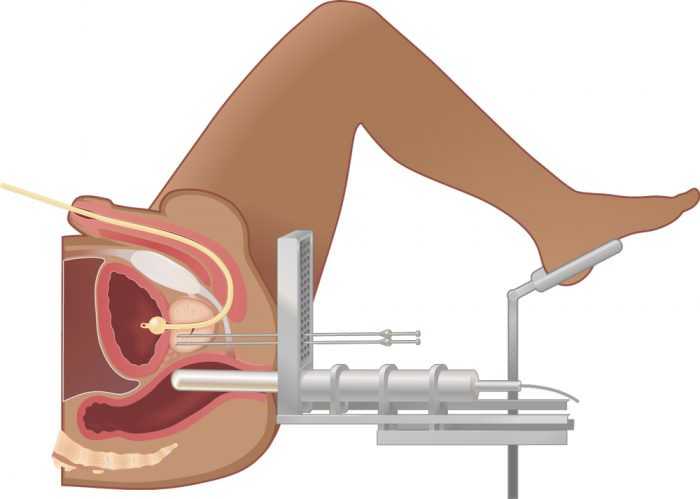
Брахитерапия
При брахитерапии небольшую гранулу, которая является источником излучения, помещают непосредственно в предстательную железу. Этот метод лечения применяется у мужчин на ранних стадиях, при которых наблюдается медленный рост.
В настоящее время используются 2 разновидности брахитерапии при РПЖ:
- Постоянная (низкодозная). Применяется изотоп йода – 125I или палладия – 103Pd.
- Временная (высокодозная). Применяется изотоп ирридия – 192Ir. Используется при местнораспространенных опухолях в сочетании с дистанционной лучевой терапией.
Как правило, брахитерапия используется на стадиях Т1с-Т2b, при уровне ПСА менее 10 нг/мл, сумме Глисона менее 7 и объеме предстательной железе до 50 см3. Среди ее преимуществ можно отметить то, что это однократная амбулаторная процедура, дает результаты аналогичные хирургическому лечению, сопровождается более низким риском развития недержания мочи, а также дает высокие шансы сохранить потенцию.
На более поздних стадиях брахитерапию иногда применяют в сочетании с дистанционной лучевой терапией.
Диагностика рака предстательной железы
Пальцевое ректальное исследование
Пальцевое ректальное исследование является рутинным методом обследования больных с подозрением на рак предстательной железы, один из основных методов обследования на ряду с измерением уровня ПСА в сыворотке крови. Преимуществами пальцевого ректального исследования является доступность, безопасность и не требует экономических затрат. Данные метод позволяет выявить опухоли предстательной железы, локализующиеся в периферических отделах, если их объём превышает 0,2 мл.
Простат-специфический антиген (ПСА)
Впервые простат-специфический антиген был выделен из семенной жидкости в 1979 г. Тогда же установили его наличие в ткани предстательной железы. В 1980 году произведен серологический тест для определения ПСА в крови. Начиная с 1987 года ПСА широко используют в диагностике рака предстательной железы, установлении стадии процесса, оценке эффективности лечения. Широкое применение в клинической практике определения уровня ПСА кардинально изменило структуру заболеваемости рака предстательной железы во всем мире. В настоящее время измерение уровня ПСА является скрининговым методом выявления рака предстательной железы.
Концентрация ПСА в сыворотке крови в норме не более 2,5 — 4 нг/мл.Повышение уровня ПСА может быть обусловлено целым рядом причин, среди которых наиболее значимыми являются:
- Рак предстательной железы;
- Доброкачественная гиперплазия предстательной железы;
- Наличие воспаления или инфекции в предстательной железе;
- Повреждение простаты (ишемия или инфаркт предстательной железы).
Механическое воздействие на паренхиму предстательной железы также приводит к повышению уровня ПСА в сыворотке крови. Такие вмешательства как, биопсия предстательной железы, трансуретральная резекция или наличие воспалительного процесса могут являться причиной значительного повышения уровня ПСА и требуют, как минимум, 4-6 недель для возврата ПСА к исходному уровню.Таким образом, обладая органо-специфичностью, ПСА не является опухолево-специфическим маркером, а потому интерпретация данных по содержанию общего ПСА в сыворотке крови пациентов должна проводиться врачом с учетом вышеуказанных факторов. В течение длительного времени верхней границей нормы считали уровень ПСА = 4,0 нг/мл. Учитывая актуальность проблемы выявления РПЖ на ранних стадиях на основе оценки уровня ПСА, было проведено несколько крупных исследований, подтвердивших остающуюся значимость ПСА-диагностики в скрининге рака предстательной железы и определивших новые подходы к пороговым значениям ПСА.
| Возраст (годы) | Среднее значение (нг/мл) | Средний предел (нг/мл) | Рекомендуемый предел (нг/мл) |
|---|---|---|---|
| 40-49 | 0,7 | 0,5-1,1 | 0-2,5 |
| 50-59 | 1,0 | 0,6-1,4 | 0-3,0 |
| 60-69 | 1,4 | 0,9-3,0 | 0-4,0 |
| 70-79 | 2,0 | 0,9-3,2 | 0-5,5 |
Таблица1. Значение условной нормы общего ПСА с учетом возраста
Наиболее сложно интерпретировать повышение уровня ПСА в диапазоне от 2,5 до 10 нг/мл, именуемом «серой зоной», так как причинами повышения ПСА наряду с раком предстательной железы являются – простатит, доброкачественная гиперплазия предстательной железы и т.д.Наряду с рекомендованным пороговым значением уровня ПСА разработаны возрастные значения нормального уровня ПСА. На основании анализа результатов обследования большого числа пациентов различных возрастных групп составлена таблица зависимости уровня ПСА от возраста. Такой подход считается более точным, чем использование определенного порога уровня ПСА, так как показатели ПСА у молодых пациентов ниже, а у пожилых — выше. Использование данных ПСА с учетом возраста пациентов способствует увеличению чувствительности и специфичности теста, а также помогает избежать «ненужных» биопсий. Однако использование возрастных пороговых значений также не имеет однозначной оценки.
Лечение рака простаты на разных стадиях
На I стадии опухоль имеет небольшие размеры, имеет низкую степень агрессивности, не распространяется за пределы простаты и характеризуется низким уровнем ПСА. Если заболевание диагностировано у пожилого мужчины, который имеет сопутствующие заболевания и у которого низкая ожидаемая продолжительность жизни, врач может ограничиться лишь наблюдением в динамике. В других случаях назначают радикальную простатэктомию или лучевую терапию.
Рак II стадии также ограничен пределами предстательной железы, но имеет более высокую степень агрессивности и характеризуется более высоким уровнем ПСА. В отличие от рака I стадии, такая опухоль при отсутствии лечения с большей вероятностью распространится за пределы предстательной железы.
Для пожилых мужчин с низкой ожидаемой продолжительностью жизни оптимальной тактикой в таких случаях также может быть активное наблюдение. У мужчин более молодого возраста без серьезных сопутствующих заболеваний прибегают к следующим видам лечения:
- Радикальная простатэктомия, во время которой, как правило, удаляют регионарные лимфатические узлы. Если обнаружено, что опухоль распространяется за пределы предстательной железы, либо уровень ПСА повышается после операции, назначают лучевую терапию.
- Лучевая терапия без хирургического вмешательства.
- Брахитерапия.
- Сочетание классической лучевой терапии и брахитерапии.
Если имеется высокая вероятность рецидива при повышенном уровне ПСА или высокой степени злокачественности опухоли, указанные методы лечения дополняют гормональной терапией в течение нескольких месяцев.
Подходы к лечению пациентов, страдающих рецидивирующим раком предстательной железы с низким уровнем ПСА, очевидно, требуют пересмотра. После публикации в начале 2019 года результатов крупного исследования стало очевидно, что назначение гормональной терапии не только не увеличивает выживаемость, но и ухудшает прогноз. Врачи «Евроонко» ознакомлены с данными результатами и используют их в своей клинической практике.
На III стадии рак распространяется за пределы предстательной железы, но мочевой пузырь и прямая кишка не поражены. Регионарные лимфатические узлы также не вовлечены в опухолевый процесс. Отдаленные метастазы отсутствуют.
В данном случае применяются следующие виды лечения:
- Лучевая терапия, которую дополняют курсом гормональной терапии.
- Классическая лучевая терапия в сочетании с брахитерапией, к которым может быть подключен короткий курс гормональной терапии.
- В отдельных случаях возможно выполнение радикальной простатэктомии с одновременным удалением тазовых лимфатических узлов. Нередко хирургическое лечение комбинируют с лучевой терапией.
- Некоторые пожилые мужчины, имеющие серьезные сопутствующие проблемы со здоровьем могут отдать предпочтение активному наблюдению, либо гормональной терапии как основному и единственному методу лечения.
В некоторых случаях для лечения рака предстательной железы III стадии могут быть применены те же методы, что и на IV стадии. В большинстве же случаев меры направлены на то, чтобы как можно дольше держать под контролем прогрессирование заболевания и обеспечить приемлемый уровень качества жизни пациента.
Существуют разные варианты лечения рака простаты на данной стадии:
- Гормональная терапия в сочетании с химиопрепаратами.
- В некоторых случаях – радикальная простатэктомия с последующим курсом лучевой терапии
- Лучевая терапия (иногда в сочетании с брахитерапией) и гормональная терапия.
- При кровотечениях и нарушении оттока мочи выполняется операция трансуретральной резекции предстательной железы (ТУР).
- При метастазах в костях назначают бисфосфонаты, лучевую терапию, радиофармпрепараты.
- Некоторым пациентам (пожилые люди с тяжелыми сопутствующими заболеваниями и низкой ожидаемой продолжительностью жизни) показано активное наблюдение.
- Симптоматическая терапия, направленная, в частности, на борьбу с болями.
Лечение гормонорезистентного рака предстательной железы
В большинстве случаев при лечении гормональными препаратами в среднем через полтора-два года опухоль перестает реагировать на терапию. Это говорит о том, что заболевание перешло в гормонорезистентную фазу. Возможные решения в данном случае:
- Гормональная терапия препаратами второй линии: энзалутамидом (антиандрогенный препарат), абиратерон (подавляет синтез мужских половых гормонов).
- Химиотерапия препаратами кабазитаксел, доцетаксел.
Распространенные последствия
Последствия лучевой терапии при раке простаты возникают из-за поражения соседних органов. Возможные негативные явления:
- недержание мочи;
- нарушения эрекции;
- рубцовые сужения (стриктуры) уретры;
- диарея;
- гематурия (кровь в моче);
- кровотечение из прямой кишки.
Поэтому при традиционной ЛТ осложнения возникают в 16% случаев (кроме эректильной дисфункции, частота которой достигает 55%), при конформной – в 8%. При брахитерапии вероятность осложнений выше чем при дистанционной, преобладают симптомы задержки мочи (до 20% наблюдений) и лучевые проктиты (5 – 21% случаев).
При возникновении осложнений проводят симптоматическое лечение. Воспаление снижают противовоспалительными средствами, задержку мочи – с помощью альфа-адреноблокаторов и так далее.
Независимо от того, появились ли осложнения, или нет, при лучевой терапии необходимо полноценное питание, отдых, длительный сон.
- Радиационное повреждение прямой кишки, мочевого пузыря и анального отверстия;
- Тошнота, рвота;
- Диарея;
- Анемия;
- Снижение иммунитета;
- Ломкость ногтей;
- Снижение потенции.
Последствия лучевой терапии при раке простаты могут быть как положительными, так и отрицательными. К последним можно отнести:
- гиперреакция тканей кишечника и структур кровообращения на получаемую радиацию;
- обширный перечень косвенных последствий – к примеру, затрудненность мочеиспускания либо половая дисфункция;
- возможность рецидива патологии.
Из положительных сторон можно указать:
- гибель большей части мутировавших клеток – рост и размножение их прекращается;
- при отдельных формах новообразований – это наиболее результативная и мягкая методика терапии.
Все последствия, которые вызывает радиоактивное излучение, делятся на местные и общие. К общим относят различные нарушения функции нейро-эндокринной, сердечно-сосудистой, кроветворной и пищеварительной систем. Поэтому у больного могут возникать:
- Тошнота и рвота.
- Одышка.
- Слабость.
- Нарушения ритма сердца.
- Угнетение кроветворения.
Местные последствия лучевой терапии при раке простаты не менее разнообразны. Они характеризуются поражением эпителия органов и эндотелия сосудов, близко расположенных к предстательной железе. Наиболее часто, по отзывам врачей, поражаются:
- Уретра и мочевой пузырь (лучевой цистит, уретрит, стриктуры уретры и обструкции мочевого пузыря).
- Прямая кишка (лучевой проктит).
- Паховые лимфоузлы (лимфостазы нижних конечностей).
Кроме того, после проведения лучевой терапии не исключены рецидивы рака простаты. Причиной его возникновения является то, что радиотерапия не устраняет биохимических или генетических причин заболевания, а воздействует лишь на появившееся новообразование. Да и современный уровень диагностики не всегда позволяет достаточно точно выявить все изменения у больного (процент ошибок установления стадии рака простаты может достигать 30%). А неправильно определенная стадия влечет неверную тактику лечения, что создает возможность рецидива.
Вероятность того, что разовьются какие-либо тяжелые последствия лучевой терапии при раке простаты, напрямую зависит от выбранной врачом дозировки, техники проводимого облучения, объема тканей, подвергшихся облучению, а также радиочувствительности здоровых тканей. Как правило, наблюдаются острые побочные реакции в период 3-месячной радиотерапии или же поздние осложнения, возникающие в срок от 1 месяца до года после радиотерапии.
Острые побочные реакции, включая воспаление слизистой прямой кишки, диарею, кровотечение и нарушение мочеиспускания, сходят на нет в течение 2-6 недель после лечения. Перед тем как приступить к облучению пациентов, оповещают о вероятности появления поздних осложнений в области мочевых путей и органов ЖКТ, нарушении эректильной функции. Хотя, как показали опросы и отзывы пациентов, лучевая терапия гораздо реже приводит к импотенции, нежели оперативное вмешательство.
Таким образом, современная медицина обладает массой средств и способов излечения рака простаты
Очень важно в данном случае как можно раньше выявить опухоль и приступить к лечению. Не менее важен и период реабилитации
Пациенту, перенесшему курс радиотерапии, необходимо выполнять все рекомендации врача для исключения вероятности развития осложнений и рецидива заболевания. В конечном итоге ответственен за свое здоровье только сам пациент.





























