Как разводить хлорное железо?
В продаже можно встретить два вида хлорного железа:
- Шестиводное хлорное железо. Напоминает мокрый песок желто-оранжевого цвета.
- Безводное хлорное железо. Порошок или комки чёрного цвета.
И то и другое отлично травит текстолит. Время травления свежеприготовленным раствором составляет порядка 5 минут, а со старым раствором время травления может увеличиваться до 20 минут и более. Для наглядности, мы приготовим совсем немного раствора и покажем, как разводить хлорное железо для травления плат.

Первым делом открываем нашу емкость с хлорным железом. Стараемся не выпачкать им руки, одежду и стол, т.к. его практически невозможно отмыть или отстирать от ткани.

Готовим посуду с водой, в которой будем делать раствор хлорного железа. Посуда должна быть пластиковой или керамической, применения металлических емкостей и инструментов категорически недопустимо. Воду в идеале лучше брать дистиллированную, но на практике все обходятся теплой прокипяченной.

Насыпаем пластиковой ложкой в емкость с водой хлорное железо и постоянно перемешиваем.
Добавлять хлорное железо лучше по пол чайной ложки за раз, раствор будет постепенно нагреваться, а также будут выделяться газы. Примерная пропорция раствора 1:3 (т.е. одна часть хлорного железа на три части воды) по весу.

Концентрацию можно определять и на глаз, хороший раствор должен быть по цвету как крепкий чай. По сути, разводить хлорное железо можно как угодно, но от этого напрямую будет завесить скорость травления платы.

Сам процесс травления лучше производить в слегка подогретом растворе. После травления плат отработанный раствор хлорного железа необходимо хранить в темном месте в герметичной таре до следующего использования.
comments powered by HyperComments
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Хлорид железа (II) |
| 102 | Другие названия | |
| 103 | Латинское название | |
| 104 | Английское название | |
| 105 | Химическая формула | FeCl2 |
| 106 | Тип | Неорганическое вещество |
| 107 | Группа | |
| 108 | Открыт | |
| 109 | Год открытия | |
| 110 | Внешний вид и пр. | |
| 111 | Происхождение | |
| 112 | Модификации | |
| 113 | Аллотропные модификации | |
| 114 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 115 | Конденсат Бозе-Эйнштейна | |
| 116 | Двумерные материалы | |
| 117 | Содержание в атмосфере и воздухе (по массе) | |
| 118 | Содержание в земной коре (по массе) | |
| 119 | Содержание в морях и океанах (по массе) | |
| 120 | Содержание во Вселенной и космосе (по массе) | |
| 121 | Содержание в Солнце (по массе) | |
| 122 | Содержание в метеоритах (по массе) | |
| 123 | Содержание в организме человека (по массе) | |
| 124 | Молярная масса |
Приложения
Хлорид железа имеет различные применения, как правило, в зависимости от его восстанавливающей способности, то есть он легко окисляется. Он используется, например, в красках и покрытиях, поскольку помогает закрепить их на поверхности.
Железо является важным микроэлементом для здоровья человека и некоторых животных. Он участвует в синтезе белка, дыхании и размножении клеток.
Следовательно, FeCl2 используется в фармацевтических препаратах. Ион Fe2+ как таковой он лучше поглощается, чем ион Fe3+ в кишечнике.
Используется для производства FeCl.3. Он используется в металлургии, в ваннах для нанесения покрытий на железо, чтобы обеспечить более пластичное покрытие.
Вот и другие варианты использования.
Инструкция
Для проявления рисунка на ножах необходимо действовать следующим образом:
- предварительно нанести рисунок на металлическом ноже либо плате (можно воспользоваться острым гвоздем);
- подобрать емкость (из пластика или металла) в зависимости от размеров изделия. Развести хлорид железа в соотношении 1 к 3 (на 1 кг вещества взять 3 литра воды);
- нагреть воду до 60-70 градусов, вылить в емкость. Небольшими порциями добавить хлорное железо, интенсивно перемешать палочкой до полного растворения соли;
- в готовый рабочий раствор поместить металлический нож либо плату. Оставить на 30-180 минут (время воздействия зависит от габаритов изделия);
- достать изделие, промыть водой и просушить.
Физические свойства:
| 200 | Физические свойства | |
| 201 | Плотность | |
| 202 | Температура плавления | |
| 203 | Температура кипения | |
| 204 | Температура сублимации | |
| 205 | Температура разложения* | |
| 206 | Температура самовоспламенения смеси газа с воздухом | |
| 207 | Удельная теплота плавления (энтальпия плавления ΔHпл) | |
| 208 | Удельная теплота испарения (энтальпия кипения ΔHкип) | |
| 209 | Удельная теплоемкость при постоянном давлении | |
| 210 | Молярная теплоёмкость | |
| 211 | Молярный объём | |
| 212 | Теплопроводность | |
| 213 | Коэффициент теплового расширения | |
| 214 | Коэффициент температуропроводности | |
| 215 | Критическая температура | |
| 216 | Критическое давление | |
| 217 | Критическая плотность | |
| 218 | Тройная точка | |
| 219 | Растворимость в воде и иных жидкостях | |
| 220 | Давление паров (мм.рт.ст.) | |
| 221 | Давление паров (Па) | |
| 222 | Стандартная энтальпия образования ΔH | |
| 223 | Стандартная энергия Гиббса образования ΔG | |
| 224 | Стандартная энтропия вещества S | |
| 225 | Стандартная мольная теплоемкость Cp | |
| 226 | Энтальпия диссоциации ΔHдисс | |
| 227 | Диэлектрическая проницаемость | |
| 228 | Магнитный тип | |
| 229 | Точка Кюри | |
| 230 | Температура Нееля | |
| 231 | Объемная магнитная восприимчивость | |
| 232 | Удельная магнитная восприимчивость | |
| 233 | Молярная магнитная восприимчивость | |
| 234 | Электрический тип | |
| 235 | Электропроводность в твердой фазе | |
| 236 | Удельное электрическое сопротивление | |
| 237 | Сверхпроводимость при температуре | |
| 238 | Критическое магнитное поле разрушения сверхпроводимости | |
| 239 | Запрещенная зона | |
| 240 | Концентрация носителей заряда | |
| 241 | Твёрдость по Моосу | |
| 242 | Твёрдость по Бринеллю | |
| 243 | Твёрдость по Виккерсу | |
| 244 | Скорость звука | |
| 245 | Поверхностное натяжение | |
| 246 | Динамическая вязкость газов и жидкостей | |
| 246 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 247 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 248 | Предел прочности на растяжение | |
| 249 | Предел текучести | |
| 250 | Предел удлинения | |
| 251 | Модуль Юнга | |
| 252 | Модуль сдвига | |
| 253 | Объемный модуль упругости | |
| 254 | Коэффициент Пуассона | |
| 255 | Коэффициент преломления |
FeCl2: структура и состав вещества
Хлорид железа (II) (FeCl2) представляет собой бинарное неорганическое соединение, состоящее из атомов железа (Fe) и хлора (Cl). Оно имеет молярную массу около 126,75 г/моль.
Структурная формула FeCl2 указывает на то, что вещество состоит из одного атома железа и двух атомов хлора. Железо образует положительный ион Fe2+, а хлор образует отрицательные ионы Cl-. В результате, общая электрическая зарядность соединения равна нулю.
В кристаллической решетке FeCl2 каждый атом железа окружен шестью атомами хлора, а каждый атом хлора окружен шестью атомами железа. Такая структура называется октаэдрической. Комплексы FeCl2 образуют цепочки, в которых атомы железа и хлора чередуются.
FeCl2 является кристаллическим веществом, которое может быть получено путем реакции хлорида железа (III) (FeCl3) с железом (Fe). Похожим образом, его можно получить также путем реакции хлорида железа (III) с металлическим железом в соответствующей стехиометрической пропорции.
FeCl2 обладает свойством восстановления и окисления. Это соединение хорошо растворяется в воде, образуя раствор с ярко-желтым цветом. Кроме того, оно является сильным окислителем, что связано со свойством двухвалентного железа переходить в трехзарядное состояние.
Уравнение реакции
Железо в соединении FeCl2 является ионом Fe2+, который способен отдавать электроны и восстанавливаться до иона железа Fe3+. В то же время присутствие окислителя, такого как HCl, приводит к окислению Fe2+ до Fe3+.
Уравнение реакции выглядит следующим образом:
FeCl2 + 2HCl → FeCl3 + H2
Где FeCl2 — восстановитель, HCl — окислитель, FeCl3 — итоговое соединение, H2 — образующийся газ.
Составление уравнения:
Уравнение для этой реакции выглядит следующим образом:
| Реагенты: | FeCl2 + HCl |
| Продукты: | FeCl3 + Cl2 |
В данной реакции FeCl2 — окислитель, так как окисление происходит с ионами железа(II) до ионов железа(III). HCl — восстановитель, так как восстановление происходит с ионами хлора до хлорида.
Что такое хлорид железа II?
Хлорид железа (II) — это FeCl2, где атом Fe находится в степени окисления +2. Его также называют хлоридом железа. Это соединение является парамагнитным, потому что у него есть неспаренные электроны, которые делают это соединение способным притягиваться к внешнему магнитному полю. Это твердое вещество коричневого цвета с высокой температурой плавления. Существует две формы хлорида железа (II): безводная форма и тетрагидратная форма.Тетрагидратная форма имеет бледно-зеленый цвет. Однако существует и менее распространенная форма дигидрата.
Твердый хлорид железа (II) может кристаллизоваться из воды в виде зеленоватого тетрагидрата. Это вещество хорошо растворяется в воде и при растворении в воде образует бледно-зеленый раствор. Мы можем производить гидратированные формы хлорида железа (II) путем обработки отходов сталеплавильного производства соляной кислотой. Этот тип растворов можно назвать отработанной кислотой или травильным раствором. Кроме того, безводная форма этого соединения может быть получена путем добавления порошка железа к раствору кислоты HCl в метаноле.

Существуют различные применения хлорида железа (II), включая производство хлорида железа (III), регенерацию кислоты HCl в процессе ее получения, в качестве коагулятора и флоккулирующего агента при очистке сточных вод, полезного для контроля запаха при очистке сточных вод и т. Д.
FeCl2 — темно-зеленые кристаллы с сильным запахом
FeCl2 представляет собой бинарное неорганическое соединение железа и хлора. Однако в природе встречается редко, обычно в виде гидратов. Оно обладает темно-зеленым цветом и имеет сильный запах.
FeCl2 обладает свойствами, которые делают его полезным в различных областях:
- Окислительные свойства: соединение может служить окислителем при реакциях с другими веществами.
- Антипригарные свойства: FeCl2 широко используется в производстве покрытий для кухонной посуды.
- Катализатор: соединение может использоваться в качестве катализатора при многих химических реакциях.
Кристаллическая структура FeCl2 позволяет ему быть растворимым в воде, образуя зеленовато-желтые растворы. Узкозонные энергетические полосы в спектре FeCl2 придают веществу его характерный цвет.
FeCl2 также хорошо растворяется в этаноле и некоторых других органических растворителях, что может быть полезным при его использовании в различных процессах.
Важно упомянуть, что FeCl2 является коррозионно-активным соединением и может оказывать влияние на окружающую среду
Поэтому необходимо соблюдать предосторожность при обращении с ним и использовать соответствующие меры безопасности
FeCl2: химические свойства
| Свойство | Описание |
|---|---|
| Окислительно-восстановительные свойства | FeCl2 может служить восстановителем в реакциях с окислителями и окисляться самостоятельно. |
| Способность к гидролизу | FeCl2 может гидролизоваться в воде, образуя растворы с кислой средой. |
| Изменение окраски раствора | В растворе FeCl2 образует желто-зеленые и зеленовато-синие соединения, в зависимости от окружающих условий. |
| Гидратационное число | FeCl2 имеет несколько степеней гидратации, включая три гидратные формы: FeCl2 • 2H2O, FeCl2 • 4H2O и FeCl2 • 6H2O. |
Химические свойства FeCl2 делают его важным компонентом в различных химических процессах и промышленных приложениях. Он используется, например, в процессах гальванизации, производстве железных сплавов и в медицине.
Структура
Хлорид железа состоит из иона двухвалентного железа Fe 2+ и двух ионов хлорида Cl -, связанных ионными связями.
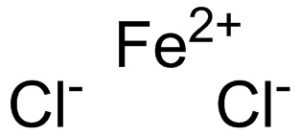
Ион двухвалентного железа Fe 2+ имеет следующую электронную структуру:
1с 2 , 2с 2 2п 6 , 3с 2 3п 6 3д 6 , 4с
где видно, что он потерял два электрона с оболочки 4s.
Эта конфигурация не очень стабильна, и по этой причине она имеет тенденцию к окислению, то есть к потере другого электрона, на этот раз из 3d-слоя, с образованием иона Fe 3+ .
В свою очередь, хлорид-ион Cl — имеет следующую электронную структуру:
1с 2 , 2с 2 2п 6 , 3с 2 3п 6
где вы можете видеть, что он приобрел дополнительный электрон в 3p-оболочке, завершив ее. Эта конфигурация очень стабильна, потому что все электронные слои завершены.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Автор статьи: Anatoly Zolotkov
В химических исследованиях
Благодаря своим восстанавливающим свойствам (противоположным окислительным) FeCl2 Он широко используется в различных исследованиях в химических, физических и технических лабораториях.
Некоторые ученые использовали пары хлорида железа для извлечения ценных металлов, таких как платина, палладий и родий, из отработанных катализаторов в автомобилях с бензиновыми или дизельными двигателями.
Эти катализаторы используются для удаления газов, вредных для человека и окружающей среды. Они расположены в выхлопной трубе легковых и грузовых автомобилей, работающих на бензине или дизельном топливе.
По прошествии определенного времени каталитический нейтрализатор автомобиля изнашивается и теряет свою эффективность, и его необходимо заменить. Отработанный катализатор утилизируется, и предпринимаются усилия по извлечению содержащихся в нем ценных металлов.
По мнению исследователей, с железом из хлорида железа эти металлы образуют магнитные сплавы.
Сплавы можно было извлекать с помощью магнитов, а затем извлекать ценные металлы известными методами.
Применение Fe и его соединений
В конце стоит сказать и о неизмеримом вкладе Fe в современную жизнь и ее сферы. В статье уже встречались строки об использовании железа в различных областях, но разберемся в этом вопросе подробнее:
- Вещества, включающие в себя Fe, широко применяются в хозяйственной деятельности. Повсеместно в качестве строительных материалов используются сплавы железа — чугун, стали и т.д. Ковкость и прочность делают Fe незаменимой деталью в громоздких и массивных сооружениях.
- Часто этот элемент применяют и в химической промышленности. Железо играет роль катализатора во многих реакциях органического и неорганического синтеза. Пириты (соединения железа и серы) применяют для выделения серы и ее производных.
- С помощью Fe2O3 производят краски, цемент, материалы, обладающие магнитными свойствами.
- Железный купорос используется в качестве защиты урожая от вредных насекомых, также он нашел применение и в гальванотехнике.
Итак, мы рассказали об основных соединениях железа, их свойствах, характеристиках, способах получения и областях применения. Стоит отметить, что данный элемент заметно выделяется на фоне остальных, рядом своих качеств и способностей. Как мы выяснили, он является незаменимым для жизни человека, значит, необходимо иметь представление о его строении, физических и химических свойствах. Для закрепления изученного материала рекомендуем пройти тест и посмотреть видео с интересными фактами.
Ссылки
- Fukuda, S. et al. (2019). Хлорид железа и сульфат железа улучшают фунгицидное действие холодной плазмы атмосферного аргона на меланизированные пуллуланы Aureobasidium. Журнал J Biosci Bioeng, 2019, 128 (1): 28-32. Восстановлено с ncbi.clm.nih.gov.
- Исмал, О.Е. и Йилдирим, Л. (2019). Протравы и биоморданты для металлов. Влияние и перспективы зеленой химии на текстильные технологии. Глава 3, с. 57–82. Восстановлено с sciencedirect.com.
- Zhang, W. et al. (2019). Совместный катализ хлорида магния и хлорида железа для получения ксилоолигосахаридов и производства глюкозы из жома сахарного тростника. Биоресур Технол 2019, 291: 121839. Восстановлено с ncbi.nlm.nih.gov.
- Чжоу, X. et al. (2015). Роль местного железа в улучшении обезвоживаемости ила за счет перекисного окисления. Научные отчеты 5: 7516. Восстановлено с ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Контроль сероводорода в канализации за счет катализа реакции кислородом. Наука об окружающей среде 689 (2019) 1192-1200. Восстановлено с ncbi.nlm.nih.gov.
- Таниноути, Ю. и Окабе, TH (2018). Восстановление металлов платиновой группы из отработанных катализаторов с использованием паровой обработки хлорида железа. Металл и материалы Trans B (2018) 49: 1781. Восстановлено с link.springer.com.
- Национальная медицинская библиотека США. (2019). Хлорид железа. Получено с: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Окисление железа (0) хлористым водородом в тетрагидрофуране: простой способ получения безводного хлорида железа (II). Неорганическая химия, том 16, № 7, 1977 г. Получено с сайта pubs.acs.org.
- Коттон, Ф. Альберт и Уилкинсон, Джеффри. (1980). Продвинутая неорганическая химия. Четвертое издание. Джон Вили и сыновья.
Моль
Все вещества состоят из атомов и молекул
В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ
Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Представление реакции в химическом подходе
| Реагент | Символьное обозначение | Роли в реакции |
|---|---|---|
| FeCl2 | Железо хлорид | Восстановитель, обеспечивает поступление электронов |
| HCl | Хлоридная кислота | Окислитель, принимает электроны |
В ходе реакции ионы железа (Fe2+) окисляются окислителем (HCl), переходя в ионы железа (Fe3+), которые вступают в реакцию с ан-ионами HCl, образуя соединения железа и ан-ионы.
Объяснение протекания реакции:
В начале реакции ионы хлорида (Cl-) из HCl реагируют соединением железа(II) и образуют осадок железа(II) хлорида (FeCl2). Это реакция восстановления, или окислительно-восстановительная реакция, так как ионы хлорида окисляются, а железо восстанавливается.
В результате, ионы хлорида (Cl-) превращаются в хлор (Cl2), который обычно выделяется в виде газа. Это происходит благодаря взаимодействию с железом как восстановителем. Таким образом, в реакции между FeCl2 и HCl образуется хлор и хлорид железа(II), а HCl служит катализатором этой реакции.
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Физические свойства
Железо -ковкий и довольно прочный металл серебристо-белого цвета. На воздухе поддается коррозии с появлением желто-оранжевого налета — ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется.Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
Реакции с неметаллами. При термическом воздействии вступает в реакции с кислородом, углеродом и галогенами, участвует в гидролизе (с температурой свыше 700 градусов).
Реакции с солями. Железо вытесняет из солей слабые металлы, то есть те, у которых меньше значение электронного потенциала.
Реакция с угарным газом. В ходе взаимодействия получаем пентакарбонил железа.
Реакции с кислотами
Уделим особое внимание:
- Железо с легкостью вступает в реакции с соляной и разбавленной серной кислотами, образуя на выходе водород и соответствующие соли.
- Также взаимодействует с концентрированной серной кислотой, но по иному механизму. Здесь происходит образование кислотного оксида, соли и воды.
- Удачно реагирует с разбавленной азотной кислотой, а в аналогичной кислоте высокой концентрации железо пассивируется. Оксидная пленка покрывает поверхность металла, вследствие чего замедляется процесс коррозии.
Теперь перейдем к детальному изучению способностей соединений железа.
Представление реакции в физическом подходе
Реакция между FeCl2 и HCl представляет собой взаимодействие катиона железа Fe2+ (FeCl2) и хлорида H- (HCl) с образованием новых соединений. В такой физической интерпретации реагенты и продукты реакции воспринимаются как частицы, обладающие определенными свойствами и состояниями.
В данной реакции FeCl2 выступает в роли исходного соединения, которое содержит два атома хлора и один катион железа Fe2+. HCl, в свою очередь, является реагентом, поставляющим хлоридные анионы Cl- и протоны H+. На протоне основывается способность HCl выступать в роли кислоты.
В результате реакции между FeCl2 и HCl происходит замещение двух хлоридных анионов Cl- из соединения FeCl2 на два протона H+, образуя воду H2O, и превращение катиона Fe2+ в катион Fe3+. Таким образом, продуктами реакции становятся новые соединения: FeCl3 и H2O.
В данном физическом подходе реакция между FeCl2 и HCl представляется как процесс взаимодействия катионов, анионов и протонов, а соединения рассматриваются на уровне их атомных и ионных составляющих. Такое представление позволяет более подробно понять и объяснить механизм и характер реакции.
Описание изменений веществ:
Реакция между FeCl2 (хлорид железа(II)) и HCl (соляная кислота) приводит к образованию новых соединений и изменениям в реагентах.
FeCl2 является восстановителем в данной реакции, так как отдает электроны. При взаимодействии с HCl он восстанавливается до железа с низкой валентностью. Таким образом, хлорид железа(II) переходит в более высокую степень окисления и превращается в катион Fe^2+.
HCl, в свою очередь, является окислителем, так как принимает электроны. При взаимодействии с FeCl2 оно окисляется до хлорида железа(III), образуя ион H^+.
Таким образом, реакция между FeCl2 и HCl приводит к образованию катиона Fe^2+ и аниона H^+, образующих новые соединения FeH^+ и Cl^-. Отрицательно заряженный анион Cl^- является одним из продуктов реакции.
| Вещество | Изменения |
|---|---|
| FeCl2 | Превращается в катион Fe^2+ |
| HCl | Превращается в анион H^+ |
Объяснение смены цвета раствора:
В начальный момент реакции раствор FeCl2 имеет зеленоватый цвет, который связан с наличием железа(II) в виде катиона Fe2+. Данный катион обладает свойством поглощать длинные волны видимого света и излучать короткие волны, что придает раствору зеленоватый оттенок.
Однако, по мере протекания реакции, FeCl2 обесцвечивается, так как железо(II) восстанавливается до железа(III) с образованием хлорида железа (FeCl3). Железо(III) образует анион FeCl4—, который не поглощает и не излучает свет в видимом диапазоне. Таким образом, раствор, который вначале имел зеленоватый цвет, становится безцветным или слегка желтоватым.
В результате реакции между FeCl2 и HCl происходит окислительно-восстановительное взаимодействие, при котором железо(II) восстанавливается, а FeCl2 окисляется до FeCl3. Эта химическая реакция является характерным примером изменения цвета раствора под влиянием восстановления и окисления веществ.
| Реагенты | Продукты |
|---|---|
| FeCl2 | FeCl3 |
| HCl |
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
При очистке сточных вод
FeCl 2 используется в очистных сооружениях или очистных сооружениях (канализационная вода).
В этом случае хлорид железа участвует в окислении шлама посредством процесса, называемого окислением Фентона. Это окисление вызывает разрыв хлопьев бурового раствора и способствует выделению воды, которая прочно с ними связана.

Затем осадок можно высушить и утилизировать экологически безопасным способом. Использование хлорида железа помогает снизить затраты на процесс.
Также недавно было предложено использовать его для уменьшения образования газообразного сероводорода или сероводорода в указанных сточных водах.
Таким образом, коррозия, вызываемая этим газом, а также неприятные запахи будут уменьшены.































