Влияние карбоната кальция на окружающую среду
Один из основных источников выбросов карбоната кальция в атмосферу – это его применение в процессе производства цемента. При горении извести (CaO), полученной из карбоната кальция (CaCO3), выделяется значительное количество углекислого газа (CO2), который считается главным представителем парниковых газов. Повышение концентрации CO2 в атмосфере приводит к усилению парникового эффекта и изменению климата на планете.
Карбонат кальция также может попадать в окружающую среду в результате выбросов из промышленных предприятий, осуществляющих добычу и обработку сырья, содержащего этот минерал. Попадание карбоната кальция в водные ресурсы может приводить к изменению их физико-химических свойств, ухудшению качества воды и влиянию на экосистему водных организмов.
Однако, карбонат кальция также может выполнять функцию нейтрализатора вредных веществ, образующихся в атмосфере или в воде. Его применение в очистке сточных вод и выбросов промышленных предприятий позволяет снизить их загрязнение и минимизировать воздействие на окружающую среду.
С целью минимизации влияния карбоната кальция на окружающую среду, необходимо применять современные технологии производства и использования данного вещества, а также осуществлять контроль за выбросами и их очистку
Для этого важно разработать и внедрить эффективные методы улавливания CO2 в процессе производства цемента и других отраслях промышленности, а также обеспечить правильное хранение и утилизацию отходов, содержащих карбонат кальция
Свойства карбоната кальция в химии
Карбонат кальция является белым кристаллическим веществом с формулой CaCO3. Он обладает высокой стойкостью к теплу и устойчив к разложению в высоких температурах. Это свойство делает его полезным в производстве цемента, стекла и керамики.
Одним из наиболее известных свойств карбоната кальция является его способность растворяться в кислотах. Когда карбонат кальция взаимодействует с кислотой, он образует соль и выделяет углекислый газ. Это явление можно наблюдать, например, когда добавляем лимонный сок или уксус к кусочку мрамора.
Другим интересным свойством карбоната кальция является его способность взаимодействовать с водой. При контакте с водой карбонат кальция может образовывать растворимую форму – гидрокарбонат кальция. Это свойство делает его полезным в производстве питьевой воды и водоподготовки.
Карбонат кальция также обладает свойствами, которые делают его незаменимым в медицине. Например, он используется в качестве добавки в пищевые продукты и лекарства для укрепления костей и зубов. Он также может использоваться в качестве антацидного средства для снижения кислотности в желудке.
Как ты видишь, карбонат кальция обладает множеством интересных и полезных свойств в химии. Он находит широкое применение в различных отраслях нашей жизни, начиная от строительства и производства, и заканчивая медициной и пищевой промышленностью. Ты, наверняка, столкнулся с продуктами, содержащими карбонат кальция, даже не задумываясь о его присутствии.
Карбонат кальция – важный компонент нашей жизни, и мы должны ценить его свойства и применение. Хотя этот минерал может показаться незначительным, он играет значимую роль в нашей повседневной жизни.
использовать
Природный карбонат кальция (известняк) в больших количествах используется в качестве сырья для промышленности строительных материалов , в качестве добавки в сталелитейной промышленности , в качестве минерального удобрения , в качестве кормовой извести и в качестве минерального наполнителя в различных промышленных применениях (например, в производстве бумаги). , краски , лаки и др.) Штукатурки , пластмассы и основы ковров ). Всего ежегодно добывается более пяти миллиардов тонн известняка.
Строительный материал
Основной областью применения является производство цемента ( силикат кальция , алюмината кальция ) и негашеную .
При сжигании извести образуется негашеная известь. Из него получают гашеную известь (гидроксид кальция Ca (OH) 2 , гашеную известь ) путем тушения водой . В свою очередь, он вступает в реакцию с двуокисью углерода в воздухе с образованием извести и замыкает цикл технической извести . Гашеная известь и известь подходят в качестве штукатурки или настенных покрытий, таких как таделакт . Первыми первооткрывателями этого явления были римляне, которые широко использовали печи для обжига извести.
наполнитель
Карбонат кальция является наиболее важным наполнителем по объему продаж во всем мире. Хотя более пяти процентов земной коры состоит из пород карбоната кальция, только несколько месторождений подходят для добычи наполнителей, которые должны быть как можно более белыми. Крупнейшим промышленным потребителем белого карбоната кальция является бумажная промышленность с объемом производства более 10 миллионов тонн (во всем мире) в год, за которой следует промышленность пластмасс и строительных материалов (штукатурки и краски) с общим объемом производства еще 15 миллионов тонн в год. Для использования в бумажной промышленности, особенно в качестве красителя , месторождения во Франции, Италии, Германии, Норвегии и Австрии разрабатываются в Европе, при этом минерал измельчается путем мокрого измельчения и продается в виде суспензии (иногда в цистернах).
сельское хозяйство
В структуре почвы содержание карбоната кальция и магния влияет на значение pH и, следовательно, на структурные свойства, биотическую активность, а также на способность накапливать и преобразовывать питательные вещества в почве. Это делает значение pH наиболее важным параметром для управления всеми типами почв. Важную роль играет достаточное количество извести со «свободным» карбонатом кальция, не связанным с частицами почвы. При известковании попытки подкисления почвы противодействует и поддержание плодородия почв или улучшение. Карбонат кальция веками использовался для улучшения плодородия почвы в сельском хозяйстве. Содержание карбоната кальция в почве определяется путем добавления 10% -ной соляной кислоты и оценки происходящей реакции, например образования пены.
Другие области применения
Карбонат кальция раньше использовался в качестве мела для школьной доски , особенно во Франции, как так называемый мел для шампанского, который состоит из меловой породы, химически очень чистого карбоната кальция. Около 55 процентов мела, продаваемого сегодня в Германии, состоит из гипса (сульфата кальция).
Карбонат кальция одобрен в качестве пищевой добавки и красителя (E 170) и часто используется, например, при выпечке булочек . Для других целей карбонат кальция дробится и / или измельчается и продается в кусках или в виде муки. Он содержится в поваренной соли в качестве вспомогательного средства .
Для некоторых применений природные карбонаты кальция не оптимальны, поэтому здесь используются синтетические карбонаты кальция. Синтетический карбонат кальция под названием Hydro-Calcit используется в технологии водоснабжения для воды с помощью « ». Этот процесс считается одним из старейших процессов раскисления.
Вместе с карбонатом магния карбонат кальция используется в препаратах, регулирующих кислотность желудочного сока ( антациды ).
Состав
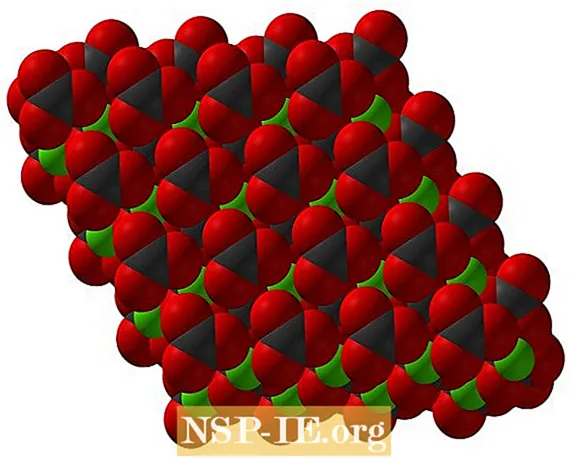
Формула карбоната кальция, CaCO3, свидетельствует о том, что соотношение ионов Са2+ и CO32- 1: 1; то есть для каждого Ca2+ есть СО32- двойник взаимодействует с ним электростатически. Таким образом, ионная связь приводит к тому, что эти ионы образуют структурные узоры, определяющие кристалл.
На верхнем изображении показана структура CaCO3. Зеленые сферы соответствуют катионам Ca2+, а красные и черные сферы — к анионам CO32-
Обратите внимание, что структура состоит из нескольких слоев: один из кальция, а другой из карбоната; что означает, что он кристаллизуется в компактную гексагональную структуру
Эта гексагональная фаза (β-CaCO3) соответствует полиморфу. Есть еще два: ромбический (λ-CaCO3) и еще более плотный гексагональный (μ-CaCO3). Изображение ниже помогает лучше визуализировать счастливый шестиугольник:
Шестиугольная структура кальцита. Специалист по материалам в английской Википедии [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)]
Однако в зависимости от температуры (и для этой соли, в меньшей степени, от давления) ионы в своих колебаниях перестраиваются в другие структуры; это уже упомянутые полиморфы (β, λ и μ).
Как бы они ни звучали, они не очень хорошо известны, если только они не будут упомянуты вместе с их минералогическими названиями в будущем разделе.
Воздействие на организм
Какие же есть полезные свойства этого вещества? Оно влияет на свертываемость крови и давление, поддержание стабильной сердечной деятельности, участвует в формировании костной ткани.
В медицине его применяют для:
- лечения изжоги;
- профилактики и лечения рахита;
- профилактики и лечения кариеса (детям);
- профилактики остеопороза.
Например, если вы пьете «Ренни» при изжоге, то прочитайте в инструкции его состав: карбонаты кальция и магния, так как они вступают в реакцию с соляной кислотой, находящейся в желудке, и нейтрализуют ее. Правда, тут есть свои тонкости, с которыми лучше посоветоваться с врачом.
Кстати, если вы решите, что вам срочно необходимо пополнить запасы кальция в организме, то не надо говорить, что вам нужен чистый кальций – это все-таки металл, причем, достаточно активный (вы же не глотаете железные гвозди, если у вас низкий гемоглобин). А вот его соединения будут в самый раз.
Я уже рассказывала о глюконате кальция и его применении. Иногда возникают споры, что лучше – глюконат или карбонат.
Если разбираться, то оба этих вещества хорошо усваиваются организмом, но глюконата требуется гораздо больше – в его составе кальция почти в четыре раза меньше, чем в карбонате.
Минус применения карбоната в том, что он нерастворим в воде, это может привести к образованию камней в почках.
Кстати, очень смешно читать про «органический» и «неорганический» кальций. Это – чушь! Нет таких понятий.
Сейчас наиболее «удобным» для организма считается цитрат кальция. Именно поэтому на разных «народных» форумах и сайтах можно встретить рецепты типа: истолочь куриную скорлупу, растворить её в лимонной кислоте (лимонном соке) и пить.
В принципе, с точки зрения химии способ правильный. В результате химической реакции между карбонатом кальция, находящемся в скорлупе, и лимонной кислотой образуется соединение под названием цитрат кальция, которое хорошо растворяется в воде.
Но как это повлияет на организм, я сказать не могу, я не врач. По отзывам врачей, оно не влияет на образование камней в почках и на кислотность желудочного сока, хорошо усваивается организмом.
Честно скажу, я этим рецептом не пользовалась – я больше доверяю аптечным препаратам, где строго выверена дозировка, а основной компонент тщательно очищен от ненужных примесей.
Ну а что касается камней в почках, которыми нас так усердно пугают все, кому не лень, то прием препаратов кальция – далеко не единственный «провокатор» их образования. Если вы пьете кофе или/и газированные напитки в бешеных количествах, употребляете много сахара и соли, ведете сидячий образ жизни, то не надо потом грешить на кальций.
Вот, пожалуй, и все на сегодня.
Всем желаю хорошего настроения! Я недавно нашла забавное видео, поделюсь им с вами:
https://youtube.com/watch?v=nk_sOp5mK-s
Наталья Брянцева
Индивидуальные доказательства
- Ханс-Иоахим Роуз: Кухонная Библия. Энциклопедия кулинарных исследований. Стр.161.
- ↑ запись на в базе данных GESTIS вещества в IFA , доступ к 16 декабря 2019 года. (Требуется JavaScript)
- паспорт (PDF) от Merck , по состоянию на 5 августа 2008 г.
- ↑ Дэвид Р. Лид (Ред.): Справочник CRC по химии и физике . 90-е издание. (Интернет-версия: 2010 г.), CRC Press / Тейлор и Фрэнсис, Бока-Ратон, Флорида, Стандартные термодинамические свойства химических веществ, стр. 5-19.
- ↑
- ↑
- ↑
- ↑ Джулиан Х. Э. Картрайт, Антонио Г. Чека, Джулиан Д. Гейл, Денис Гебауэр, К. Игнасио Сайнс-Диас: Полиаморфизм карбоната кальция и его значение для биоминерализации: сколько аморфных фаз карбоната кальция существует? В: Angewandte Chemie. 124, 2012 г., стр. 12126, DOI : 10.1002 / anie.201203125 .
- Wissenschaft-Online-Lexika: Проверено 3 августа 2011 года.
- WV Boynton, DW Ming, SP Kounaves, SM Young, RE Arvidson, MH Hecht, J. Hoffman, PB Niles, DK Hamara, RC Quinn, PH Smith, B. Sutter, DC Catling, RV Morris: Доказательства наличия карбоната кальция в место посадки «Марс Феникс». В кн . : Наука.
- Ceresana Research 2007.
- Compakt Handbuch Chemie 1993, ISBN 3-8174-3560-6 , стр. 387.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.;
- в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Наименование показателя | Норма |
|---|---|
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
Таблица 2.
| Диэлектрическая проницаемость (при 17-22°C) при 104 Гц: | |
|---|---|
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| Диэлектрическая проницаемость (при 17-22°C) при 108 Гц: | |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
Таблица 3.
| Удельное электрическое сопротивление мрамора при 20°C: | |
|---|---|
| объемное, Ом·см | 109-1011 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·109 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·107 |
| Удельное электрическое сопротивление дисперсии 5г CaCO3 в 100 мл воды при 23 °C, Ом: | |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·1014 |
Таблица 4. Физические свойства различных типов карбонатов.
| Показатели | Кальцит CaCO3 (наиболее устойчивая модификация) | Арагонит CaCO3 (метастабильная модификация, переходит в кальцит) | Доломит CaCO3-MgCO3 (45% масс. MgCO3) | Магнезит MgCO3 |
|---|---|---|---|---|
| Плотность, кг/м3 | 2600 — 2750 | 2920 — 2940 | 2800 — 2900 | 3000 — 3100 |
| Твердость по Мосу | 3,0 | 3,5 — 4,0 | 3,5 — 4,0 | 3,5 — 4,5 |
| Содержание растворимых фракций | 0,99·10-8 (при 15°C)0,87·10-8 (при 25°C) | — | — | 2,6·10-5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы.Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т<30°C | — | — |
Фармакологическое действие и показания к применению
Главным образом кальция карбонат применяется для предотвращения разрушения костной ткани или ее восстановления.
Так, средство назначается при таких состояниях:
- кариес;
- остеопороз – усиление хрупкости костей и уменьшение их плотности;
- остеомаляция – нарушение минерализации ткани, приводящее к излишней гибкости костей;
- рахит – расстройство образования костной ткани в детском возрасте;
- переломы костей;
- повышение потребности в кальции в детском возрасте (период роста), во время беременности или грудного вскармливания.
Благодаря своей способности регулировать проводимость нервных импульсов в ЦНС, лекарство используют при повышенной склонности к парестезиям и судорогам (тетания).
Кальция карбонат рекомендуется при дефиците минерала во время применения некоторых лекарственных средств (глюкокортикостероиды) и при некоторых патологических состояниях (гипопаратиреоз, гиперфосфатемия, почечная остеодистрофия).

Лекарство можно использовать в качестве антацидного средства: взаимодействуя с кислотой в полости желудка, кальция карбонат нейтрализирует ее и убирает симптомы раздражения слизистой. Поэтому таблетки используются при изжоге или острой интоксикации, а также в комплексной терапии гастрита, эрозий слизистой оболочки органов ЖКТ, рефлюксной болезни, дуоденита.
Обратите внимание! Во время взаимодействия кальция карбоната с кислым содержимым желудка, происходит выделение углекислого газа: под его влиянием стенки желудка растягиваются и раздражаются, что приводит к вторичному выделению желудочного сока.
Химические свойства
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- \displaystyle{ \mathsf{ CaCO_3 \longrightarrow CaO + CO_2 \uparrow}. }
Растворяется в воде при избытке углекислого газа, образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- \displaystyle{ \mathsf{CaCO_3+CO_2+H_2O \longrightarrow Ca(HCO_3)_2}. }.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- \displaystyle{ \mathsf{CaCO_3 + 4C \longrightarrow CaC_2 + 3CO \uparrow} }.
Реагирует с сильными кислотами с вытеснением угольной кислоты, которая тут же разлагается на воду и углекислый газ:
- \displaystyle{ \mathsf{CaCO_3 + 2HCl\rightarrow CaCl_2 + CO_2\uparrow + H_2O}. }
Данная реакция используется для лабораторного получения углекислого газа в аппарате Киппа
Применение
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на школьных досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Использование в пищевой промышленности
- Е170 учавствует в организме в процессах свертывания крови;
- применяется в медицине как биологически активная добавка;
- используется в приготовлении различных кондитерских кремов и хлеба;
- используется в соевом молоке как часть кальциевой диеты;
- применяется для окрашивания различных конфет (например, драже);
- используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах;
- является антикристаллизатором в сгущеном молоке;
- стабилизирует консистенцию джемов и желе;
- вместе с другими карбонатами может применятся при изготовлении различных сыров (плавленных, домашних);
- не дает выпасть осадку.
Массовое производство/использование
Таблетки из карбоната кальция
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла. Широко используется при производстве продукции личной гигиены (например, зубной пасты), и даже в медицинской промышленности. В пищевой промышленности часто используется в качестве антислеживающего агента и разделителя в сухих молочных продуктах. При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей карбоната кальция (более 50 % всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т. п. Карбонат кальция составляет порядка 20 % красящего пигмента, используемого при производстве красок.
Строительство
Строительство — еще один из основных потребителей карбоната кальция. Шпатлевки, различные герметики — все они содержат карбонат кальция в значительных количествах. Также, карбонат кальция является важнейшим составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция также широко используется в очистительных системах, как средство борьбы с загрязнением окружающей среды, при помощи карбоната кальция восстанавливают кислотно-щелочной баланс почвы.
Описание действующего вещества Кальция карбонат/Calcium carbonate.
Формула: CaCO3, химическое название: карбонат кальция.Фармакологическая группа: органотропные средства/ желудочно-кишечные средства/ антациды;
Метаболики/ макро- и микроэлементы.Фармакологическое действие: противоязвенное, антацидное, восполняющее дефицит кальция.
Фармакологические свойства
Карбонат кальция нейтрализует соляную кислоту, тем самым снижая кислотность желудочного сока. Препарат действует быстро, но после прекращения буферного воздействия усиливается секреция желудочного сока. Снижает активность остеокластов и замедляет резорбцию костной ткани. Нормализует электролитный баланс. Также кальций является микроэлементом, который участвует в процессах свертывания крови, формирования костной ткани, необходим для стабильной работы сердца, осуществления передачи нервных импульсов.
Показания
Повышенная кислотность желудочного сока и болезни системы пищеварения, которые протекают на ее фоне (обострение хронического гастрита, острый гастрит и дуоденит, обострение язвенной болезни, симптоматические язвы различного происхождения, рефлюкс-эзофагит, эрозии слизистой, изжога после избыточного приема никотина, этанола, кофе, погрешностей в диете, приема лекарственных средств); остеопороз, включая и постменопаузный; кариес и рахит у детей (терапия и профилактика); тетания, остеомаляция; повышенная необходимость в кальции (кормление грудью, период интенсивного роста у детей, беременность и прочие состояния); аллергические реакции (вспомогательная терапия); гипокальциемия (при повышенном выведении кальция или сниженном его всасывании, при гипопаратиреозе, продолжительной терапии глюкокортикоидами, почечной остеодистрофии).
Способ применения кальция карбоната и дозы
Препарат принимается внутрь независимо от приема пищи, 2 – 3 раза за сутки по 0,25–1 г.
При пропуске очередного приема карбоната кальция принять его, как вспомните, последующий прием произвести через установленное время от последнего использования.
При продолжительном использовании высоких доз препарата необходимо регулярно контролировать содержание кальция в крови и показатели работы почек. Карбонат кальция в форме таблеток, которые предназначены для профилактики и терапии кариеса, остеопороза и рахита не стоит использовать в качестве антацидного средства.
Противопоказания к применению
Гиперчувствительность, гиперкальциурия, гиперкальциемия (передозировка витамином D, гиперпаратиреоидизм, костные метастазы), нефроуролитиаз, множественная миелома, хроническая почечная недостаточность, фенилкетонурия, саркоидоз.
Применение при беременности и кормлении грудью
При беременности и в период грудного кормления использовать карбонат кальция можно, но только по показаниям при назначении врачом.
Побочные действия кальция карбоната
Аллергические реакции, явления диспепсии (метеоризм, боль в эпигастрии, тошнота, диарея/запор), гиперкальциемия (при приеме доз больше 2 г кальция в сутки), вторичное усиление желудочной секреции.
Взаимодействие кальция карбоната с другими веществами
При совместном приеме с другими препаратами карбонат кальция может замедлить их всасывание. При совместном использовании с тетрациклинами снижает их концентрацию в плазме крови, что приводит к понижению их клинической эффективности. При совместном использовании с тиазидными диуретиками появляется возможность развития метаболического алкалоза и гиперкальциемии. При совместном использовании с индометацином снижается его (индометацина) всасывание и его раздражающее воздействие на желудочно-кишечный тракт. При совместном использовании снижается клиническая эффективность левотироксина.
Передозировка
При передозировке карбонатом кальция развивается молочно-щелочной синдром или гиперкальциемия (при приеме больше 2 г кальция в сутки) — слабость, головная боль, нарушение аппетита (возможна анорексия), тошнота, запор, рвота, боли в животе, полиурия, жажда, вялость, боль в суставах и мышцах, поражения почек, нарушение сердечного ритма. Необходимо промывание желудка, прием активированного угля, поддержание жизненно важных функций, симптоматическое лечение.
DC Calcium Carbonate представлены следующими видами:
- СМ90 – гранулированный Карбонат Кальция. Идеально подходит для таблеток, требующих высокого уровня карбоната кальция и высокой твердости. CM90 может использоваться как в процессе влажного гранулирования, так и в процессе прямого прессования. Состоит из 90% карбоната кальция и 10% мальтодекстрина.
- CS90 — пористый карбонат кальция с хорошими органолептическими свойствами. Идеально подходит для антацидных составов и пищевых добавок, особенно когда таблетка должна иметь низкий вес. CS90 имеет высокую площадь поверхности. Он легко прессуется методом прямого прессования и исключает необходимость в процессах влажной грануляции (это позволяет снизить общий вес таблетки). Состоит из 90% карбоната кальция и 10% крахмала.
- CS95 – гранулированный Карбонат Кальция. Он имеет относительно высокую плотность и позволяет производить тонкие таблетки. Из-за этих характеристик, CS95 идеально подходит для приготовления продуктов с более высокой концентрацией кальция, которые имеют относительно низкий вес таблетки. Состоит из 95% карбоната кальция и 5 % крахмала.
- Vitasmooth — это очень компактный и органолептически приятный состав Карбоната Кальция, специально разработанный для производства жевательных таблеток путем прямого прессования. Состоит из карбоната кальция 58%, декстрозы, сахарозы, МКЦ и мальтодекстрина.
Преимущества DC Calcium Carbonate:
- Отличная прессуемость;
- Великолепные органолептические качества;
- Высокое содержание карбоната кальция ;
- Хорошие показатели сыпучести;
- Доступен в качестве вспомогательного вещества.
Благодаря вышеперечисленным свойствам карбонаты кальция можно использовать в антацидных мягких жевательных таблетках, мультивитаминах для детей с кальцием и антацидных средствах в форме ОДП.
Спецификация:
| Продукт | Насыпная плотность (г/мл) | Насыпная плотность при уплотнении (г/мл) | Угол откоса (°) | Индекс Карра | Содержание (%) | Характеристики |
|---|---|---|---|---|---|---|
| СМ90 | 1,212 | 1,462 | 42,2 | 17,1 | 90% карбоната кальция, 10% мальтодекстрина | Нет крахмала,высокая плотность |
| CS90 | 0,805 | 0,87 | 36,6 | 7,5 | 90%карбоната кальция, 10% крахмала | Хорошо прессуется, хорошая органолептика |
| CS95 | 1,070 | 1,339 | 40,2 | 20,1 | 95% карбоната кальция,5% крахмала | Высокая плотность |
| Vitasmooth | 0,617 | 0,802 | 36,8 | 23,1 | 58% карбоната кальция, Декстроза Сахароза МКЦ Мальтодекстрин | Хорошо прессуется, хорошая органолептика |
Готовы предоставить дополнительную информацию, помочь в подборе продукта и предоставить образцы!






























