Содержание:
В фосфат алюминия представляет собой неорганическое твердое вещество, образованное ионом алюминия Al 3+ и фосфат-ион PO4 3- . Его химическая формула — AlPO.4. Это белое твердое вещество, кристаллическая структура которого похожа на структуру кремнезема SiO.2. Не растворяется в воде.
Его можно получить из оксида алюминия (Al2ИЛИ3) и фосфорной кислоты (H3PO4). Также его можно получить, исходя из водных растворов хлорида алюминия (AlCl3) и фосфат натрия (Na3PO4).
Фосфат алюминия имеет очень высокую температуру плавления, поэтому он широко используется в качестве компонента огнеупорных керамики, то есть, керамики, которые выдерживают очень высокие температуры.
Он также используется в качестве антацида для желудка, в смесях для восстановления зубов и в качестве адъюванта к вакцинам, то есть для стимуляции иммунного ответа организма.
Некоторые огнеупорные бетоны содержат AlPO.4 в своем составе, что увеличивает механические и жаропрочные поддерживающие свойства этого типа цемента.
Он использовался в качестве защитного экрана для предотвращения горения горючих материалов, таких как определенные полимеры.
Чем можно заменить
На основе действующего вещества фосэтил алюминия производится препарат «Альэтт», применяемый для обработки лука, огурцов, земляники. Более широким спектром применения отличается препарат «Эфатол», который используют для опрыскивания винограда, груш, черешни, подсолнечника, яблони, персика.
Не стоит недооценивать использование пестицидов, поскольку применение веществ способствует увеличению урожайности. В современных условиях плодородность земли снижается, климатические условия меняются, и без использования ядохимикатов становится сложно бороться с болезнями и вредителями растений.
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
- 4 AlPO4 → 2 Al2O3 + P4O10
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
- NaAlO2 + H3PO4 →t∘ AlPO4 + NaOH + H2O
- 2 Na3PO4 + Al2(SO4)3 → 2 AlPO4 ↓ + 3 Na2SO4
|
Соединения алюминия |
|---|
|
Как работает препарат и для чего его используют
Фосэтил алюминия – системный пестицид. Отравление вредных насекомых происходит в процессе распространения раствора по сосудистой системе растений. Порошок выполняет следующие функции:
- защитная – предупреждает поражение растений грибками или насекомыми, препятствует распространению вредителей. Рекомендуется полностью обрабатывать растительные культуры раствором препарата;
- лечебное качество позволяет оказывать помощь растениям, пораженным вредителями. При обработке больных растений нужно понимать, что их урожайность будет пониженной.
Действие препарата начинается уже через 30-40 минут после обработки растительных культур. Поскольку раствор быстро проникает в растение, то нет угрозы его смывания при дожде или поливе. А защитные качества сохраняются в течение 2-3 недель.

Дар природы и результат химической реакции

Мало кто из нас задумывался, приобретая в аптеке лекарство от изжоги, что оно является даром природы. Ведь фосфат алюминия, являющийся действующим веществом многих антацидных препаратов.
Понятно, что для промышленных целей, в том числе и медицинских, фосфат алюминия получают искусственным путем. Но все же это вещество встречается и в природе, а не только в химических лабораториях и производствах. Людям издавна известно, что алюминиевые соединения нужны организму человека. Он и содержатся в некоторых продуктах питания, например, в зернах овса и пшеницы, в горохе, рисе, фасоли, персиках. наукой еще недостаточно изучена роль алюминиевых соединений, которые находятся в организме человека. Единственное, что можно сказать с уверенностью, недостаток таких веществ в организме и человека и животных приводит к некоторым нарушениям. Так, например, может повышать частота самопроизвольных выкидышей, сказывается на состоянии костей, участвует в регенерационных процессах. переизбыток алюминия в организме вреден так же, как и его недостаток. поэтому поступление этого вещества с пищей должно быть сбалансированным.
В медицине же соединения алюминия применяют в лечебных целях как наружные средства, так и для приема внутрь.
Техника безопасности при использовании фунгицида
Нельзя исключать риска вредного воздействия пестицидов на организм человека при попадании на кожу или слизистые в процессе опрыскивания растений
Поэтому важно придерживаться правил техники безопасности:
- опрыскиванием занимаются в одежде с длинными рукавами, обеспечивающей защиту тела;
- рекомендуется предварительно надеть резиновые перчатки, глаза защитить специальными очками, голову покрыть головным убором;
- при разведении порошка придерживаются инструкций от производителя.
После обработки растений нужно тщательно умыться проточной водой, руки помыть с мылом
Важно учитывать рекомендации производителя порошка, указанные на упаковке
Фосфат алюминия — это… Что такое Фосфат алюминия?
Фосфат алюминия (ортофосфат алюминия, алюминий фосфорнокислый) — AlPO4, неорганическое соединение, алюминиевая соль фосфорной кислоты. Твёрдое, белое кристаллическое вещество, нерастворимое в воде. Встречается в природе в виде минерала берлинита. Образуется в виде студёнистого осадка при действии на водорастворимые соли алюминия растворимых фосфатов.
Используется в качестве флюса в производстве керамики, добавки для цемента, высокотемпературного дегидратирующего агента, для выпуска специальных сортов стекла, как катализатор в органическом синтезе. Также применяется как компонент для некоторых разрыхлителей в кондитерском деле и в медицине как антацид.
Нахождение в природе и физические свойства
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы:
- Плотность: 2,64 г/см³, удельная теполёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Соединение плохо растворимо в воде (ПР 9,83·10−10) и спирте, хорошо растворимо в соляной и азотной кислоте. Хуже всего соль растворима в воде при pH 4,07—6,93.
При осаждении их водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x=2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Получение и химические свойства
Фосфат алюминия довольно устойчивое соединение, разлагающееся при температуре выше 2000 °C:
Получают нагреванием алюмината натрия с фосфорной кислотой или обменной реакцией сульфата алюминия с водорастворимыми фосфатами:
Примечания
- ↑ Алюминия фосфат // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1988. — Т. 1. — С. 217—218.
- ↑ Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 13—14. — ISBN 0-07-049439-8
- ↑ Тихонов В.Н. Аналитическая химия алюминия. — Серия «Аналитическая химия элементов». — М.: «Наука», 1971. — С. 17.
Шаблон:АТХ код A02
Использование в керамике
Фосфат алюминия AlPO4 он часто входит в состав глиноземной керамики.
Керамика с высоким содержанием глинозема — один из материалов, который из-за своей твердости используется в приложениях, где требуется выдерживать высокие нагрузки и суровые условия.
Этот тип керамики устойчив к коррозии, воздействию высоких температур, присутствию горячего пара или восстановительной атмосфере, такой как окись углерода (CO).
Глиноземная керамика также имеет низкую электрическую и теплопроводность, поэтому ее используют для изготовления огнеупорных кирпичей и электроизоляционных компонентов.
Поскольку фосфат алюминия образуется при гораздо более низкой температуре, чем кремнезем SiO2, его производство дешевле, что является преимуществом при производстве керамики, подходящей для требовательных услуг.
Фосфат алюминия применение в медицине. Фосфат алюминия
Фармакология
В желудке в течение 10 мин повышает pH до 3,5-5 и снижает протеолитическую активность пепсина. Антацидный эффект не сопровождается ощелачиванием желудочного сока и вторичной гиперсекрецией соляной кислоты. Благодаря адсорбирующим свойствам, удаляет из ЖКТ бактерии, вирусы, газы, эндо- и экзотоксины.
Применение
Для взрослых: язвенная болезнь желудка и двенадцатиперстной кишки, гастрит с нормальной или повышенной секреторной функцией, диафрагмальная грыжа, рефлюкс-эзофагит, синдром неязвенной диспепсии, функциональная диарея, желудочные и кишечные расстройства, вызванные интоксикацией, приемом лекарственных препаратов, раздражающих веществ (кислоты, щелочи), алкоголя.
Для детей: эзофагит, гастроэзофагеальный рефлюкс, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки.
Ограничения к применению
Пожилой возраст, нарушения функции почек (возможно увеличение концентрации алюминия в плазме крови), беременность, грудное вскармливание.
Меры предосторожности
Не следует принимать длительно без назначения врача
С осторожностью применяют при заболеваниях почек, циррозе печени, выраженной сердечной недостаточности. У пожилых пациентов и больных с нарушением функции почек при применении в рекомендованных дозах возможно увеличение концентрации ионов Al 3 + в сыворотке крови
При запоре, возникающем при приеме препарата, рекомендуется увеличить количество ежедневно потребляемой воды.
Взаимодействия с другими действующими веществами
| Дигоксин* |
На фоне алюминия фосфата снижается всасывание дигоксина. |
| Изониазид* |
На фоне алюминия фосфата снижается всасывание изониазида.
– не редкость. Сказывается все – торопливый образ жизни, неправильное и нерегулярное питание, стрессы, нарушенный распорядок дня. Да и болезни постоянно атакуют. Поэтому фармацевтическая промышленность постоянно ищет все новые и новые лекарственные средства, помогающие справиться с такими проблемами. Такие препараты бывают последствиями длительно работы ученых, составления многих компонентов в единое действенное средство. А бывают препараты, которые нам дала сама природа, соединив все необходимое в единое вещество без участия ученых. Например, фосфат алюминия.
Дар природы и результат химической реакции
Мало кто из нас задумывался, приобретая в аптеке лекарство от изжоги, что оно является даром природы. Ведь фосфат алюминия, являющийся действующим веществом многих антацидных препаратов.
Понятно, что для промышленных целей, в том числе и медицинских, фосфат алюминия получают искусственным путем. Но все же это вещество встречается и в природе, а не только в химических лабораториях и производствах. Людям издавна известно, что алюминиевые соединения нужны организму человека. Он и содержатся в некоторых продуктах питания, например, в зернах овса и пшеницы, в горохе, рисе, фасоли, персиках. наукой еще недостаточно изучена роль алюминиевых соединений, которые находятся в организме человека. Единственное, что можно сказать с уверенностью, недостаток таких веществ в организме и человека и животных приводит к некоторым нарушениям. Так, например, может повышать частота самопроизвольных выкидышей, сказывается на состоянии костей, участвует в регенерационных процессах. переизбыток алюминия в организме вреден так же, как и его недостаток. поэтому поступление этого вещества с пищей должно быть сбалансированным.
В медицине же соединения алюминия применяют в лечебных целях как наружные средства, так и для приема внутрь.
Ортофосфорная кислота H3PO4
Ортофосфорная (фосфорная) кислота является трехосновной кислотой средней силы (ее соли — фосфаты или ортофосфаты).
Графическая формула H3PO4:
- бесцветные прозрачные кристаллы;
- температура плавления 42°C;
- неограниченно растворяется в воде, с образованием водородных связей, как между собой (высокая вязкость раствора), так и с молекулами воды (высокая растворимость).
H3PO4 диссоциирует в три ступени:
- H3PO4 H++H2PO4— (Kдис=7,5·10-3)
- H2PO4— H++HPO42- (Kдис=6,2·10-8)
- HPO42- H++PO43-(Kдис=5,0·10-13)
В водном р-ре фосфорной кислоты преобладают ионы H+ и H2PO4-, поскольку константы второй и третьей ступени диссоциации намного меньше, чем константа первой ступени.
Несмотря на тот факт, что фосфорная к-та обладает всеми свойствами общих кислот, она намного слабее, например, азотной или серной кислоты, и не обладает, в отличие от сильных кислот, сколь-нибудь значительными окислительными свойствами, что объясняется устойчивой степенью окисления фосфора (+5).
Как трехосновная кислота H3PO4 образует средние соли и два вида кислых солей, например:
- фосфат натрия — Na3PO4
- гидрофосфат натрия — Na2HPO4
- дигидрофосфат натрия — NaH2PO4
В промышленности ортофосфорную кислоту получают воздействием серной кислоты на фосфориты и апатиты (экстракционный метод):
Ca3(PO4)2+3H2SO4 = 2H3PO4+3CaSO4
Более чистая кислота получается сжиганием фосфора с последующим растворением в воде образующегося оксида P2O5.
Фосфорную кислоту применяют в производстве:
- удобрений;
- химических реактивов;
- органических веществ;
- катализаторов;
- защитных покрытий на металлах;
- в фармацевтической промышленности.
Ссылки
- Абызов, В.А. (2016). Легкий огнеупорный бетон на основе алюмо-магний-фосфатного связующего. Разработка процедур 150 (2016) 1440-1445. Восстановлено с sciencedirect.com.
- Ваг, А.С. (2016). Керамика из фосфата алюминия. В химически связанной фосфатной керамике (второе издание). Глава 11. Восстановлено с sciencedirect.com.
- Mei, C. et al. (2019). Адъювант вакцины на основе фосфата алюминия: анализ состава и размера с использованием автономных и встроенных инструментов. Comput Struct Biotechnol J. 2019; 17: 1184-1194. Восстановлено с ncbi.nlm.nih.gov.
- Qin, Z. et al. (2019).Синергетический барьерный эффект фосфата алюминия на огнестойкий полипропилен на основе системы полифосфат аммония / дипентаэритрит. Материалы и конструкция 181 (2019) 107913. Получено с sciencedirect.com.
- Vrieling, H. et al. (2019). Наночастицы стабилизированного фосфата алюминия, используемые в качестве адъюванта вакцины. Коллоиды и поверхности B: Биоинтерфейсы 181 (2019) 648-656. Восстановлено с sciencedirect.com.
- Шефер, К. (2007). Желудочно-кишечные препараты. Антациды. В лекарствах во время беременности и кормления грудью (второе издание). Восстановлено с sciencedirect.com.
- Rouquerol, F. et al. (1999). Свойства некоторых новых адсорбентов. При адсорбции порошками и пористыми телами. Восстановлено с sciencedirect.com.
50 отличных фраз аниме (вдохновляющих и запоминающихся)
Алюминиевый фосфат в производстве красок и лаков
Алюминиевый фосфат является важным компонентом в производстве красок и лаков. Его уникальные свойства делают его неотъемлемой частью различных формул и рецептур, обеспечивая высококачественное покрытие и защиту поверхности.
Особенности алюминиевого фосфата в производстве красок и лаков:
- Алюминиевый фосфат обладает отличной адгезией, что позволяет ему прочно связываться с поверхностью и образовывать стойкое покрытие.
- Он обеспечивает защиту от коррозии и воздействия агрессивных сред, улучшая долговечность покрытия.
- Алюминиевый фосфат способствует улучшению механических свойств красок и лаков, придавая им устойчивость к истиранию и повреждениям.
- Он также улучшает стойкость к погодным условиям, ультрафиолетовому излучению и другим внешним воздействиям.
Применение алюминиевого фосфата в производстве красок и лаков:
Алюминиевый фосфат используется в различных видах красок и лаков, включая:
- Антикоррозионные краски и покрытия для металлических поверхностей. Алюминиевый фосфат обеспечивает эффективную защиту от ржавчины и коррозии, а также повышает адгезию покрытия к металлу.
- Акриловые и эпоксидные краски. Алюминиевый фосфат улучшает механические свойства красок, придавая им высокую устойчивость к истиранию и повреждениям.
- Фасадные краски и покрытия. Алюминиевый фосфат обеспечивает стойкость к погодным условиям, ультрафиолетовому излучению и другим внешним воздействиям, сохраняя яркость и прочность покрытия.
В производстве красок и лаков алюминиевый фосфат играет важную роль, обеспечивая высокую защиту и качество покрытий. Его уникальные свойства делают его незаменимым компонентом в различных формулах и рецептурах, гарантируя долговечность и эстетическую привлекательность поверхностей.
В вакцинах
АльПО4 В течение многих лет он использовался в различных вакцинах для человека для усиления иммунного ответа организма. Говорят, что АлПО4 это «адъювант» вакцин. Механизм еще недостаточно изучен.
Известно, что иммуностимулирующий эффект AlPO4 это зависит от процесса адсорбции антигена на адъюванте, то есть от способа, которым он к нему прикрепляется. Антиген — это соединение, которое при попадании в организм вырабатывает антитела для борьбы с определенным заболеванием.
Антигены могут адсорбироваться на AlPO4 электростатическим взаимодействием или связыванием с лигандами. Они адсорбируются на поверхности адъюванта.
Также считается, что размер частиц AlPO4 он также имеет влияние. Чем меньше размер частиц, тем больше и продолжительнее ответ антител.
Химическая стойкость сплавов алюминия
В дистиллированной воде алюминий проявляет очень хорошие показатели стойкости к коррозии при любой температуре.
Дождевая вода может разрушать алюминий, если в атмосфере содержится значительное количество промышленных газов. Растворяясь в воде, это газы (SO2, NO2, хлороводород и т.д.) образуют кислоты, разрушающие алюминий. Поэтому во избежание коррозии алюминиевые конструкции следует проектировать так, чтобы свести до минимума скапливание дождевой воды на поверхности металла.
Водопроводная вода действует на алюминий по-разному, в зависимости от содержащихся в ней примесей. В кислых или щелочных водах алюминий может подвергаться коррозии. Процесс коррозии ускоряют ионы хлора или тяжелых металлов, содержащиеся в водопроводной воде.
Промышленные сточные воды вызывают очень сильную коррозию, которую ускоряют ионы тяжелых металлов.
Водород, азот и благородные газы (гелий, аргон, неон, криптон, ксенон) не действуют на алюминий даже при повышенных температурах.
Галогены (хлор, бром, йод, фтор) в отсутствие влаги не действуют на алюминий. При взаимодействии с водой они образуют кислоты, агрессивные по отношению к алюминию.
Сухие хлороводород, бромоводород, йодоводород, фтороводород не действуют на алюминий. Но водные растворы этих газов — кислоты, активно разрушающие алюминий.
Сероводород не разрушает алюминий при температуре до 500°С.
Двуокись серы в отсутствие водяного пара не разрушает алюминий (до 400°С), хотя при наличии влаги вызывает коррозию. Аналогично действует и триокись серы.
Аммиак в газообразном состоянии не действует на алюминий даже при высоких температурах.
Оксид углерода СО разрушает алюминий только при температуре свыше 550°С.
Углекислый газ ведет себя аналогично СО. В воде углекислый газ образует угольную кислоту, не вызывающую значительных коррозионных разрушений.
Что такое фосфат алюминия, виды, формула
Фосфат алюминия представляет собой алюминиевую соль фосфорной кислоты. Она состоит из атомов фосфора, который находится в степени окисления +5, алюминия, заряженного как +3 и кислорода с отрицательным зарядом -2. Химическая формула алюминия фосфата – AlPO4. По расположению составляющих компонентов выделяют два варианта вещества:
- альфа- AlPO4 – менее устойчив к температурным воздействиям, шестиугольный;
- бета- AlPO4 – высокая термоустойчивость, элементарная ячейка – куб.
По количеству атомов водорода, входящих в состав соединения, различают кислые и основные соли фосфатов алюминия. Они отличаются по свойствам и описываются разными формулами:
- формула алюминия трифосфата Al2(PO4)(OH)3;
- формула алюминия дигидрофосфата Al(H2PO4)3;
- формула алюминия монофостфата AlH3(PO4)2.
В природе фосфат алюминия чрезвычайно распространён. Он входит в состав более чем 15 минералов, месторождения которых расположены по всему миру. Один из них – лазулит – железно-алюминиевый фосфат представлен пирамидальными кристаллами небесно-синего цвета (формула – (Mg, Fe)Al2(OH,PO4)2). Иногда яркая окраска может отсутствовать, что обусловлено примесью магния. Характеризуется стеклянным блеском, излом неровный, черта надлома – белая. Лазулит не отличается крепкостью, его твёрдость по шкале Мооса составляет 5,5-6,5.
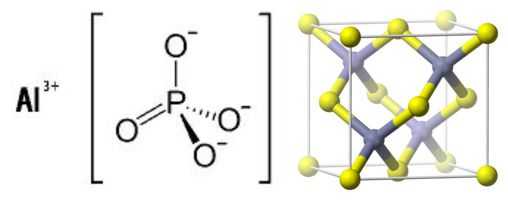
Химическая формула и структура фосфата алюминия
Фосфат алюминия находят в амблигонитах, которые формируют массивные агрегаты и зернистые высокоплотные массы (формула – (Li, Na)AlPO4(F,OH)). Для них характерна небольшая желтоватая люминесценция, цвет образований золотисто-жёлтый, иногда они не окрашены. Прозрачность крайне высокая, иногда минерал просвечивает, блестит. Внешне амблигонит можно перепутать с полевым шпатом, он довольно хрупкий. Его находят зачастую в литиевых рудах, в обогащённых фосфором пегматитовых жилах. Редко его подвергают огранке, такие экземпляры добывают в Бразилии, Намибии, США, Франции.
Что входит в состав и препаративная форма
Препарат относится к группе фосфорорганических соединений. Имеет несколько сходных названий: этил фосфит алюминия, фосэтил, фосэтил алюминия. Средство хорошо растворяется в воде, значительно хуже – в органических растворителях. Производится в виде смачивающегося водорастворимого порошка с концентрацией 80 %, стабилен в водных растворах, подходит для длительного хранения без потери свойств.
Относится к классу пестицидов и фунгицидов, легко проникает в систему растения, обладает защитным и иммунизирующим действием. В торговые сети поступает в герметичных полимерных пакетах объемом 2,5 килограмма.
Безопасность использования алюминиевого фосфата
Алюминиевый фосфат является безопасным веществом при правильном использовании
Однако, необходимо соблюдать определенные меры предосторожности для минимизации возможных рисков и негативных последствий
Вот несколько важных мер безопасности при использовании алюминиевого фосфата:
- Хранение: Алюминиевый фосфат должен храниться в герметично закрытой упаковке вдали от прямого солнечного света и влаги. Также следует избегать хранения вместе с другими химическими веществами, чтобы избежать возможных реакций.
- Использование защитного снаряжения: При работе с алюминиевым фосфатом рекомендуется использовать защитные очки, перчатки и маску, чтобы избежать контакта с кожей, глазами и дыхательными путями.
- Вентиляция: Работа с алюминиевым фосфатом должна проводиться в хорошо проветриваемом помещении или под вытяжной вентиляцией, чтобы избежать накопления паров или пыли.
- Избегайте попадания на открытые раны: Если алюминиевый фосфат попадает на открытые раны или порезы, необходимо тщательно промыть их водой и обратиться за медицинской помощью при необходимости.
- Не употребляйте внутрь: Алюминиевый фосфат предназначен только для внешнего использования. Не следует принимать его внутрь без указания врача, так как это может вызвать нежелательные побочные эффекты и осложнения.
В случае возникновения аллергической реакции, раздражения кожи или других неприятных симптомов при использовании алюминиевого фосфата, следует немедленно прекратить его использование и проконсультироваться с врачом.
В целом, соблюдение указанных мер безопасности при использовании алюминиевого фосфата позволит минимизировать возможные риски и обеспечить безопасное взаимодействие с этим веществом.
Нормы расхода и инструкция по применению
Есть определенные нюансы при обработке отдельных растительных культур фосэтилом алюминия (рекомендации указаны в таблице):
| Название культуры | Расход порошка (г/сотку) | Особенности использования |
| Виноград | 25 | опрыскивают от милдью перед цветением, в период формирования ягод, с интервалом 10-14 дней |
| Лук | 20-25 | в период вегетации обрабатывают от пероноспороза |
| Огурцы | 20 | в период вегетации обрабатывают от пероноспороза |
| Персики, груша, черешня | 0,5 % раствором | обрабатывают от фитофторозной гнили после цветения |
| Яблони | 0,5 % раствором | основу штамба после цветения поливают раствором от фитофторозной гнили |
Коррозия алюминия и его сплавов (док)
Низкая плотность и механическая прочность в сочетании с удовлетворительной стойкостью к коррозии делают алюминий привлекательным конструкционным материалом, который широко используется в строительстве. Однако с химической точки зрения алюминий — один из наиболее реакционноспособных металлов, который активно взаимодействует не только с кислотами и щелочами, но и с водой! Кажущееся противоречие очень просто объясняется: под воздействием кислорода (или других окислителей) поверхность металлического алюминия покрывается прочной, химически устойчивой оксидной пленкой, предохраняющей металл от разрушения. Это явление называется пассивацией. Металл пассивен в том случае, когда при взаимодействии с потенциальным источником коррозии он не подвергается изменениям, и активен тогда, когда агрессивное вещество его разрушает.
Напомним, что коррозией называется процесс разрушения металлов и их сплавов в результате химического или электрохимического воздействия окружающей среды.
Металл, стойкий к коррозии в одних условиях, может разрушаться в других. Так, например, алюминий стоек к коррозии, вызываемой жидким топливом, и не стоек к действию натриевой щелочи (так называемое явление пассивности и активности).
Окись алюминия создает химически инертный защитный слой, толщина которого составляет 20—100Å. Алюминий, поверхность которого очищена от защитной пленки, может реагировать с водой, выделяя при этом водород. Под влиянием окислителей поверхность алюминия пассивируется, поэтому кислород, содержащийся в воздухе или растворенный в воде, повышает его коррозионную стойкость.
Коррозионная стойкость алюминия в значительной степени зависит от содержания примесей других металлов. Как известно, при контакте двух металлов, погруженных в среду электролита, образуется гальваническая пара, где более активный металл становится анодом, а менее активный — катодом. В результате электрохимической реакции анод разрушается. Большинство примесей (за исключением металлов, более активных, чем алюминий) играют роль катода по отношению к алюминию, т.е. способствуют его разрушению.
По этой причине алюминий высокой чистоты отличается более высокой коррозионной стойкостью, чем технический металл, который, в свою очередь, более устойчив к коррозии, чем сплавы алюминия. Кроме того, коррозионная стойкость алюминия зависит от характеристик окружающей среды и от реакций, вызываемых этой средой в алюминии.
Нахождение в природе[править | править код]
Белое (в аморфном виде) или бесцветное кристаллическое вещество, существующая в четырёх модификациях, среди которых устойчивы:
α-AlPO4 — с гексагональной решёткой (пространственная группа P3121), устойчив до 580 °C;
- Плотность: 2,64 г/см³, удельная теплоёмкость: 93,2 Дж/(моль·К), стандартная энтальпия образования: −1733 кДж/моль, стандартная энергия Гиббса: −1617 кДж/моль, стандартная энтропия: 90,8 Дж/(моль·K).
β-AlPO4 — с гексагональной (580—1047 °C) или кубической (выше 1047 °C) решёткой.
Физические свойстваправить | править код
Соединение плохо растворимо в воде (ПР 9,83⋅10−10) и спирте, хорошо растворимо в соляной и азотной кислоте. Хуже всего соль растворима в воде при pH 4,07—6,93.
При осаждении из водных растворов выпадает в виде аморфного осадка общей формулой AlPO4•xH2O. Известны кристаллогидраты, где x = 2; 3,5. Безводную соль можно получить при нагревании фосфата выше 1300 °C.
Известны основные и кислые соли фосфата алюминия: Al2(PO4)(OH)3, Al(H2PO4)3, AlH3(PO4)2 и др.
Минералы фосфата алюминияправить | править код
В природе фосфат алюминия входит в состав следующих многочисленных минералов (список не является исчерпывающим):
- альдерманит: Mg5Al12(PO4)8(OH)22 • 32H2O
- амблигонит: (Li,Na)AlPO4(F,OH)
- ахейлит: (Fe2+,Zn)Al6(PO4)4(OH)8 • 4H2O
- аугелит: Al2(PO4)(OH)3
- берлинит: AlPO4 • xH2O
- бразилианит: NaAl3(PO4)2(OH)4
- вантасселит: Al4(PO4)3(OH)3 • 9H2O
- варисцит: AlPO4 • 2H2O
- воксит: Fe2+Al2(PO4)2(OH)2 • 6H2O
- лазулит: (Mg,Fe2+)Al2(OH,PO4)2
- скорцалит: ((Mg,Fe2+)Al2(OH,PO4)2)
- таранакит: (K,Na)3(Al,Fe3+)5(PO4)2([HPO4)6 • 18H2O
- цириловит: NaFe3+3(PO4)2(OH)4 • 2(H2O)
- чилдренит: (Fe,Mn)AlPO4(OH)2 • H2O
- эосфорит: MnAlPO4)(OH)2 • H2O
Состав и физико-химические свойства
Внешне кислота выглядит как светло-желтый раствор или бесцветная масса. Доля хлористого цинка в общей массе составляет минимум 50%. Нерастворимый осадок вещества не должен превышать 0,001% от общей массы вещества. Возможны добавления аммиака, примерно, 0,5%. Исходя из представленной формулы вещества Н3РО4, можно сделать вывод, что это трехосновная кислота, которая имеет среднюю силу. Если она будет взаимодействовать с более сильными кислотами, то будет проявлять признаки амфотерности, а также образовывать фосфорита. При контакте с водой, она проходит через электролитическую диссоциацию.
Вещество нельзя назвать безопасным, так что во время пайки желательно применять средства индивидуальной защиты, чтобы исключить попадание на кожу и глаза. Кислота очень хорошо растекается по основному материалу и обеспечивает высокую эффективность спаивания. Это относительно агрессивная среда, так что при взаимодействии с тонкими контактами или другими деталями, она может оказать негативное влияние на материал. Паяльная кислота или ортофосфорная кислота лучше всего проявляет свои свойства во время спаивания металлов с высокой температурой плавления. Она одинаково хорошо взаимодействует как с черными, так и цветными металлами. Материал хорошо растворяется в воде.








![§ 33. кислородные соединения фосфора [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://ivbellen.ru/wp-content/uploads/a/a/d/aadbb53640a6f6c08a2f5d0dbde9ffba.jpeg)



















