Прогнозы и лечение кардиомиопатии
Кардиомиопатии, которые обнаруживаются на поздних сроках своего развития, не подлежащие ранее лечения, в конечном итоге переходят в тяжелую сердечную недостаточность, вызывает дисфункцию клапанов.
Дополнительно могут развиться сопутствующие осложнения – аритмии, тахикардии, остановки сердца, тромбоэмболии.
Женщинам следует воздержаться от планирования беременности до момента излечения, так как процент смертности в таком случае будет значительно повышен.Единой общей схемы лечения нет. К каждому случаю подбирается индивидуальная терапия.
При наличии вторичных миокардиопатий устраняется основное заболевание параллельно с устранением последствий.Для первичных форм на первом месте стоят меры по предотвращению осложнений и снятию основных симптомов.
Самым первым, что нужно сделать человеку с кардиомиопатией, это отказаться от вредных привычек, следить за своим рационом, а так же исключить тяжелые физические нагрузки.
Для лечения используют препараты, которые помогут поддержать и восстановить работу сердца. При терапии дилатационной и гипертрофической миокардиопатии назначают препараты, уменьшающие степень развития сердечной недостаточности, лекарства, уменьшающие потребность сердечной мышцы в кислороде (группа В-адреноблокаторов), препараты снижающие артериальное давление. Для устранения отеков применяются препараты мочегонного действия.
Так как нередким осложнением выступают эмболии, рекомендуется применять препараты разжижающие кровь.
При тяжелых случаях развития заболевания, а так же при отсутствии терапевтического эффекта от лечения, применяется хирургическое вмешательство. В него входит имплантация кардиостимуляторов для людей, страдающих гипертрофической формой, пересадка сердца при дилатационной форме.
При эндомиокардиальном фиброзе человека ждет неблагоприятный прогноз. Пересадки сердца в большинстве случаев эффекта не дает. Патология часто возникает снова. При этой форме заболевания назначают поддерживающую терапию.
В целях профилактики можно пить отвары трав из тысячелистника, ромашки, корня валерианы, ландыша, мяты.
Диагностика кардиомиопатии
 В обязательном порядке назначают лабораторные исследование крови и мочи.
В обязательном порядке назначают лабораторные исследование крови и мочи.
В общем анализе крови нет изменений до тех пор, пока не появятся воспалительные осложнения и образования микроскопических тромбов. Только в этом случае изменяются показатели креатинина, электролитов, тромбиновое время.
По показаниям проводят биохимическое исследование крови. Рассматривают мочевину, гормоны и белок.
Инструментальные методы диагностики:
- ЭКГ – электрокардиограмма 1-2 раза в сутки. Обнаруживается нарушение проводимости и ритмов сердца. В результатах исследования не должно быть ишемии миокарда (уменьшение кровоснабжения).
- Рентген всех органов грудной клетки. Помогает определить застой венозной крови в малом круге кровообращения, соотношение размеров и границ сердца по отношению к грудной клетке.
- Коронарография – обследование коронарных сосудов, назначают с целью подтверждения или исключения ишемической болезни сердца.
- Радионуклидная вентрикулография – оценивают функциональность сердца и сократительную способность миокарда.
Также пациентам назначают эндомиокардиальную биопсию. Это метод позволяет дать точную морфологическую оценку состоянию тканей сердца. Показания к процедуре:
- прогрессирующая сердечно-сосудистая недостаточность, причину которой не удается установить;
- кардиомиопатия невыясненной этиологии;
- нарушение ритма сердца;
- токсическое разрушение миокарда;
- поражение сердца после длительного лечения цитостатиками – препараты для химиотерапии.
При дифференциальной диагностике важно исключить такие патологии: ИБС (ишемическая болезнь сердца), гипертонию, пороки сердца врожденные и приобретенные, хронический алкоголизм, перикардит, ревматизм
Кардиомиопатия
Кардиомиопатия — патологическое изменение сердечной мышцы невыясненной этиологии; проявляется кардиомегалией, сердечной недостаточностью, нарушениями сердечного ритма и проводимости. Кардиомиопатии патогенетически не связаны с врождёнными аномалиями развития, клапанными пороками сердца, перикардитом. системными заболеваниями сосудов, артериальной гипертонией. Для кардиомиопатий с известным этиологическим фактором был предложен термин специфические кардиомиопатии .
. В зарубежной медицинской литературе термин кардиомиопатия иногда употребляют вместо термина миокардиодистрофия. используя его для обозначения вторичных неизолированных поражений миокарда известной этиологии (например, алкогольная кардиомиопатия).
Варианты кардиомиопатий по классификации, разработанной ВОЗ и МОФК (1995):
Функциональная классификация Дилатационная кардиомиопатия — характеризуется дилатацией полостей сердца, с возникновением систолической дисфункции; толщина стенок при этом не увеличивается. Гипертрофическая кардиомиопатия — характеризуется гипертрофией стенки стенки левого или правого (иногда обоих) желудочков. Гипертрофия чаще асимметричная, поражается преимущественно межжелудочковая перегородка. Рестриктивная кардиомиопатия — наблюдается ригидность миокарда, в связи с чем наполнение кровью камер сердца ограничено. Аритмогенная правожелудочковая кардиомиопатия — характеризуется прогрессирующим фиброзно-жировым замещением миокарда правого желудочка (иногда — левого желудочка); заболевание имеет явно семейный характер, однако, не всегда проявляется по наследственной линии. Специфические кардиомиопатии Ишемическая кардиомиопатия — дилатация прежде всего левого желудочка с нарушением сократительной функции миокарда, которое не объясняется степенью обструкции коронарных артерий или ишемического повреждения. Клапанная кардиомиопатия — характеризуется желудочковой дисфункцией, которая несоизмерима с условиями патологической нагрузки, обусловленной клапанным стенозом и регургитацией. Гипертензивная кардиомиопатия — гипертрофия левого желудочка, возникшая на фоне артериальной гипертензии с явлениями сердечной недостаточности. обусловленной систолической или диастолической дисфункцией. Воспалительная кардиомиопатия — нарушение функции сердца в результате миокардита. Метаболическая кардиомиопатия — поражение миокарда при эндокринных заболеваниях, гипокалиемии, болезнях накопления гликогена, нарушениях питания. Кардиомиопатии при системных заболеваниях — поражения миокарда при системных заболеваниях соединительной ткани и инфильтративных заболеваниях (саркоидоз, лейкоз). Кардиомиопатии при мышечных дистрофиях (миотонической, дистрофии Дюшена, Бекера). Кардиомиопатии при нейромышечных нарушениях (атаксии Фридрейха, лентигинозе, синдроме Нунан). Кардиомиопатии при гиперчувствительности и токсических реакциях — поражение сердечной мышцы под влиянием катехоламинов, антрациклинов, алкоголя, воздействия радиации и др. Перипартальная (послеродовая) кардиомиопатия — редкая дилатационную форма кардиомиопатии, ассоциированная с систолической дисфункцией и прогрессирующей сердечной недостаточностью, проявляющуюся в третьем триместре беременности или в течение 5 месяцев после родов. Неклассифицированные кардиомиопатии — заболевания, которые трудно отнести к какой-либо категории кардиомиопатий (митохондриальные болезни, фиброэластоз и др.).
Согласно классификации, предложенной Американской кардиологической ассоциацией (2006) все случаи заболевания можно отнести к первичной или вторичной кардиомиопатии.
Первичная кардиомиопатия — заболевание, характеризующееся изолированным или преимущественным поражением миокарда; может быть: наследственная (генетическая) — дефекты проведения, митохондриальные миопатии и др.; приобретённая — стресс-индуцированная, послеродовая и др.; смешанная. Вторичная кардиомиопатия — поражение миокарда, возникающая при системном заболевании; она бывает: инфильтративная; накопления; эндомиокардиальная; токсическая (включая лекарственную и радиационную); воспалительная (гранулёматозная); эндокринная; при нервно-мышечных заболеваниях; алиментарная; связанная с системными заболеваниями соединительной ткани.
Прогноз
Прогноз при рестриктивной ВМД зависит от причины заболевания, но в целом неблагоприятный — смерть в течение 5 лет у 70% пациентов.
Расширенный CMD является тяжелым заболеванием с очень плохим прогнозом, время выживания составляет два года. При семейном муковисцидозе только 34–36% пациентов имеют муковисцидоз. Для вирусного / иммунного DCMP этот процент составляет 50%.
Если у алкогольной кардиомиопатии уже развилась сердечная недостаточность и пациент не бросил пить, прогноз плохой: смерть от алкогольной кардиомиопатии наступает в 75% случаев в течение 3 лет. Прекращение употребления алкоголя до начала тяжелой сердечной недостаточности может остановить или даже обратить вспять прогрессирование ACMP.
В гипертрофической форме возможны два варианта в зависимости от мутации гена. От этого также зависит продолжительность жизни при гипертрофической кардиомиопатии. При наличии злокачественных мутаций с высокой степенью проникновения генов (частота экспрессии генов в признаках), степенью гипертрофии, тяжелым течением и осложнениями, высоким риском смерти, продолжительностью жизни до 30-35 лет.
Мутации в гене тропонина Т характеризуются высокой смертностью (до 90%) даже при отсутствии гипертрофии миокарда. При легких мутациях наблюдается низкое проникновение генов, мало характерная клиническая картина, низкий риск смерти, и подавляющее большинство пациентов живут дольше 60 лет. Большинство пациентов умирают внезапно, и часто это первое проявление болезни (у подростков и молодых людей). Около 40% смертей наступает после физических упражнений, 60% — в состоянии покоя.
При ишемической БКМ существует корреляция между выживаемостью пациента и жизнеспособным объемом миокарда, который может быть увеличен с помощью операции коронарного шунтирования. При ишемической кардиомиопатии причиной смерти считается тромбоэмболическая и тяжелая сердечная недостаточность. Коронарное шунтирование стало обычным хирургическим вмешательством на сердце. За счет восстановления васкуляризации сердечной мышцы приступы стенокардии устраняются, но сократимость миокарда не улучшается, и, таким образом, не устраняется первопричина смерти.
По этой причине пациентам проводится комбинированная операция — реваскуляризация миокарда и реконструкция левого желудочка (внутрижелудочковая лоскутная ткань). Это улучшает функцию сердечной мышцы и уменьшает размер и форму левого желудочка. Успешное хирургическое лечение может обратить вспять ремоделирование миокарда.
Прогноз при врожденной кардиомегалии сомнительный, так как младенцы умирают в 30% случаев, а выжившие имеют серьезные пороки сердца, но остаются жизнеспособными.
Диагностика
Признаки сердечной недостаточности
Диагностика токсической кардиомиопатии часто несвоевременна и трудна в связи с тем, что длительное время симптомы заболевания отсутствуют. Внешне признаки токсической кардиомиопатии заметны тогда, когда имеет место выраженная сердечная недостаточность. На ранних этапах токсическая кардиомиопатия может быть выявлена с помощью эхокардиографического исследования сердца. Тогда можно увидеть признаки дилатации и умеренной гипертрофии левого желудочка. Когда появляются признаки токсической кардиомиопатии, самые простые методы диагностики позволяют заподозрить поражение сердца.
- Осмотр пациента. Уже на этом этапе по внешнему виду можно предположить, что человек злоупотребляет алкоголем. Если имеют место признаки сердечной недостаточности, в покое может отмечаться одышка, синеватый оттенок кончиков пальцев, кончика носа, мочек ушей. Могут быть отеки нижних конечностей. Нередко злоупотреблением алкоголем сопровождается циррозом печени. В таком случае можно заметить наличие «сосудистых звездочек» на туловище, ярко-красную окраску губ, изменение окраски ладоней, пониженная масса тела и др. Если имеет место контакт с другим токсическим веществом, при отсутствии признаков сердечной недостаточности осмотр пациента будет малоинформативным.
Аускультация сердца
Пальпация, перкуссия и аускультация сердца. При токсической кардиомиопатии может быть выявлен аритмичный и частый пульс. Границы сердца расширены, при выслушивании тонов они приглушены, может выслушиваться частое сердцебиение, систолический шум вследствие развития относительной сердечной недостаточности.
Электрокардиографическое исследование. Для пациентов с токсической кардиомиопатией характерны различные нарушения ритма сердца и проводимости. Однако все эти изменения неспецифичны и, как правило, указывают на перегрузку тех или иных отделов сердца. Проводя электрокардиографическое обследование, могут быть выявлены экстрасистолы, пароксизмы мерцательной аритмии, желудочковой тахикардии, атриовентрикулярные блокады и блокады ножек пучка Гиса, чаще левой. Кроме нарушений ритма и проводимости, может иметь место умеренная гипертрофия миокарда левого желудочка и предсердия, а также изменения процессов реполяризации (депрессия сегмента ST и отрицательный несимметричный зубец Т).
ЭхоКГ сердца с кардиомиопатией
Эхокардиографическое исследование. ЭхоКГ или УЗИ сердца является наиболее информативным неинвазивным методом диагностики токсической кардиомиопатии. Он позволяет выявить изменения на довольно ранних сроках заболевания. Основными признаками токсической кардиомиопатии на ЭхоКГ являются расширение (дилатация) всех камер сердца. Следующий признак — преобладание дилатации над гипертрофией миокарда желудочков. При ЭхоКГ также можно выявить снижение сократительной функции миокарда левого желудочка, обратный заброс крови на митральном и трехстворчатом клапанах (митральная регургитация). В полости желудочков могут выявляться пристеночные тромбы. Рентгенографическое исследование. При проведении рентгенографического исследования органов грудной клетки выявляется увеличение размеров сердца за счет левого желудочка на начальных этапах, а затем и всех камер сердца, что придает ему шаровидную форму.
Другие методы диагностики. Для выявления токсической кардиомиопатии могут также быть использованы сцинтиграфическое исследование миокарда, велоэргометрия, коронароангиографическое исследование, катетеризация полостей сердца, эндомиокардиальная биопсия.
Первичная кардиомиопатия у взрослых
Причинный фактор первичной кардиопатии (или правильно – кардиомиопатии) нередко остается неизвестным. С учетом морфологических изменений и расстройств функциональных способностей, которые происходят при этом патологическом состоянии, выделяют такие виды первичной идиопатической кардиопатии:
- Гипертрофическую кардиомиопатию (ГКМП) со свойственной для нее изолированной гипертрофией межжелудочковой перегородки либо непропорциональной гипертрофией желудочка (чаще левого) с выпячиванием в полость правого утолщенной межжелудочковой перегородки;
- Дилатационную (ДКМП) или застойную форму, для которой характерно расширение всех камер сердца, однако и в данном случае чаще других страдает левый желудочек;
- Рестриктивную (РКМП) или облитеративную, существующую в двух разновидностях (эндокардиальный фиброз и эндомиокардиальный фиброэластоз Леффлера), которые между собой патоморфологически особо не отличаются: в обоих случаях эндокард утолщен значительно, а, кроме этого, присутствуют признаки гипертрофии мышц желудочков с увеличением или уменьшением полостей последних;
- Аритмогенную (жировую, фиброзно-жировую) дисплазию правого желудочка, которую называют болезнью Фонтана – довольно редко диагностируемый патологический процесс в сердечной мышце, сформированный в результате замены (часто по неизвестным причинам) клеток миокарда (кардиомиоцитов) на клетки другой ткани (соединительной, жировой).
Дилатационная кардиомиопатия – преобладание дилатации камер сердца над гипертрофией миокарда, снижение сократимости миокарда и прогрессирование сердечной недостаточности, устойчивой к лечению.
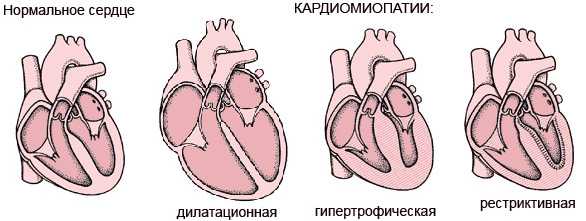
Расширение камер и увеличение массы сердца – основная отличительная черта дилатационной формы кардиомиопатии (вес сердца может достигать килограмма или превышать эти значения). Предполагается, что начало развития данной формы скрывается за неумеренным потреблением алкогольных напитков или воздействием инфекционных агентов, однако не всегда причины удается выявить и в большинстве случаев происхождение болезни остается загадкой. Что касается алкоголя, то он действительно может вызывать развитие алкогольной кардиопатии со значительным увеличением камер сердца, но тогда это уже будет вторичное нарушение, ровно, как и в случае дилатационной ишемической кардиопатии, формирующейся в результате прогрессирования атеросклеротического процесса. Очевидно, что разграничение по происхождению и причисление болезни к первичной или вторичной патологии относительно кардиопатий (или кардиомиопатий) представляет определенные трудности.
Лечение дилатационной кардиомиопатии похоже на терапию тяжелой сердечной недостаточности, однако эти больные плохо переносят сердечные гликозиды, поэтому им назначают негликозидные инотропные препараты (допамин) в сочетании с мочегонными, а кроме этого:
- Бета-блокаторы;
- Антагонисты кальция;
- Периферические вазодилататоры, которые помогают снизить излишнюю нагрузку на легочный круг кровообращения и облегчить сердечный выброс.
К сожалению, дилатационная КМП значительно сокращает жизнь, через 5 – 6 лет пациентов обычно настигает внезапная смерть по причине нарушения ритма или тромбоэмболии.
Предпочтительные кардиопротективные препараты
С целью кардиопротекции предпочтительным препаратом из группы ИАПФ является эналаприл.
Онкологические пациенты с СН — никаких предпочтений нет. Можно начинать с лечения короткодействующими препаратами, например с каптоприла, и титровать дозу с целью избегания гипотонии.
Из БРА II показали профилактическую эффективность по отношению к антраци-клин- индуцированной КМП валсартан, телмисартан.
Онкологическим пациентам с СН рекомендуются кандесартан, валсартан, лозартан. Остальные препараты не исследованы.
Из β-АБ наиболее исследован карведилол. Это неселективный β- и α-блокатор, оказывает вазодилатирующее, антиан-гинальное и антиаритмическое действие, а также антиоксидантное действие за счет устранения свободных кислородных радикалов.
Небиволол — высокоселективный ББ с дополнительными вазодилатирующими свойствами. В эксперименте и клиническом исследовании обладает кардиопро- тективным эффектом.
Пропранолол в эксперименте усиливал кардиотоксичность.
В клиническом исследовании метопро-лол дал нейтральный результат, не было ухудшения или улучшения прогноза (больные невысокого риска).
При систолической СН рекомендуются карведилол, бисопролол, метопролол.
Целевые дозы препаратов такие же, как в рекомендациях по СН (табл. 2.33 или см. главу «Лечение сердечной недостаточности»).
Профилактические меры кардиотоксического эффекта лучевой терапии Способы предотвращения поздних эффектов.
Оптимизация терапии (химиотерапии и лучевой терапии).
Мониторирование сердечных и легочных функций.
Влияние на кардиоваскулярные факторы риска (отказ от курения, контроль липидов, нормализация веса, физическая активность, правильное питание и др.).
Таблица 2.33. Доказанные дозы лекарственных препаратов, влияющих на течение 0заболевания, использованные в ключевых рандомизированных клинических исследованиях по сердечной недостаточности (или после инфаркта миокарда)
|
Стартовая доза, мг |
Целевая доза, мг |
|
|
ИАПФ |
||
|
Каптоприла |
6,25 (3 р/сут) |
50 (3 р/сут) |
|
Эналаприл |
2,5 (2 р/сут) |
20 (2 р/сут) |
|
Лизиноприла |
2,5-5 (1 р/сут) |
20-35 (1 р/сут) |
|
Рамиприл |
2,5 (1 р/сут) |
10 (1 р/сут) |
|
Трандолаприла |
0,5 (1 р/сут) |
4 (1 р/сут) |
|
ББ |
||
|
Бисопролол |
1,25 (1 р/сут) |
10 (1 р/сут) |
|
Карведилол |
3,125 (2 р/сут) |
25 (2 р/сут)d |
|
Метопролол (CR/XL) |
12,5/25 (1 р/сут) |
200 (1 р/сут) |
|
Небивололс |
1,25 (1 р/сут) |
10 (1 р/сут) |
|
БРА |
||
|
Кандесартан |
4-8 (1 р/сут) |
32 (1 р/сут) |
|
Валсартан |
40 (2 р/сут) |
160 (2 р/сут) |
|
Лозартанb,c |
50 (1 р/сут) |
150 (1 р/сут) |
|
Антагонисты альдостерона |
||
|
Эплеренон |
25 (1 р/сут) |
50 (1 р/сут) |
|
Спиронолактон |
25 (1 р/сут) |
50 (1 р/сут) |
|
Ингибитор рецепторов ангиотензина-неприлизина |
||
|
Валсартан + сакубитрил |
49/51 (2 р/сут) |
97/103 (2 р/сут) |
|
Ингибитор If-каналов |
||
|
Ивабрадин |
5 (2 р/сут) |
Примечание: а — показывает, где целевая доза ИАПФ была взята из исследований с постинфарктными пациентами; b — указывает на препараты, более высокие дозы которых продемонстрировали снижение заболеваемости-смертности по сравнению с низкими, но нет существенных плацебо-контролируемых РКИ и оптимальные дозы не установлены; с — указанное лечение не показало снижение кардиоваскулярной и общей смертности у пациентов с СН или после острого ИМ (не ухудшало эффективность проводимого лечения); d — максимальная доза 50 мг может быть назначена пациентам с массой >85 кг. Сокращения: ИАПФ — ингибиторы ангиотензинпревращающего фермента; ББ — β-блокаторы, БРА — блокаторы рецепторов ангиотензина.
Пути снижения лучевой нагрузки на сердце.
- Правильное определение объема средостения и регионарных лимфатических узлов.
- Правильное определение объемов здоровых тканей.
- Использование новых технологий и методики, например, трехмерное планирование, которое более точно позволяет определить локализацию опухоли и критических органов, более точный расчет дозы.
- Фракционированная лучевая терапия, продолжительная лучевая терапия малыми фракциями.
Классификация заболевания
Кардиомиопатия может быть:
- первичной – когда причина или неизвестна, или на нее невозможно повлиять (например, дефект генов);
- вторичной, когда причину можно найти.
Первичная кардиомиопатия имеет свою классификацию, где каждый подвид отличается по своей причине, основным симптомам и подходам к лечению. Так, она бывает:
- дилатационной;
- гипертрофической;
- рестриктивной;
- аритмогенной правожелудочковой.
Классификация вторичной патологии базируется на причине заболевания. Так, кардиомиопатия бывает:
- дисгормональной (в том числе тиреотоксической, диабетической и климактерической);
- дисметаболической;
- ишемической;
- токсической (в том числе алкогольной);
- Такоцубо;
- алиментарной.
12.2. ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ
Гипертрофическая кардиомиопатия — достаточно распространённое поражение сердца генетической природы, характеризующееся утолщением стенок левого желудочка. Гипертрофия стенки левого желудочка более 15 мм неясного генеза считается диагностическим критерием гипертрофической кардиомиопатии.
Различают обструктивную (сужающую выносящий тракт левого желудочка) и необструктивную гипертрофические кардиомиопатии. Гипертрофия может быть симметричной (увеличение с вовлечением всех стенок левого желудочка) и асимметричной (увеличение с вовлечением одной из стенок). Гипертрофия может охватывать изолированно лишь верхушку сердца (апикальная гипертрофическая кардиомиопатия). При гипертрофии верхней части межжелудочковой перегородки непосредственно под фиброзным кольцом аортального клапана говорят о мышечном субаортальном стенозе.
Важными общими особенностями гипертрофической кардиомиопатии (как с обструкцией, так и без неё) выступают высокая частота нарушений ритма сердца, прежде всего желудочковой экстрасистолии и пароксизмальной тахикардии. С аритмиями связывают внезапную смерть, наступающую у 50% больных гипертрофической кардиомиопатией.
Эпидемиология
Гипертрофическую кардиомиопатию наблюдают у 0,2% населения, чаще в виде необструктивных форм (70-80%), реже — обструктивных (20-30%, в виде идиопатического гипертрофического мышечного субаортального стеноза). Заболеваемость у детей составляет 0,3-0,5 случаев на 100 000 населения. Нередко болезнь развивается в зрелом и пожилом возрасте, хотя в последнем случае диагностика заболевания может вызвать трудности, поскольку возможна связь заболевания с атеросклеротическим поражением. Мужчины болеют чаще женщин. Возможно сочетание болезни с другой патологией генетической природы.
ЭТИОЛОГИЯ
Гипертрофическую кардиомиопатию считают наследственным заболеванием. Она наследуется аутосомно-доминантным путём в результате мутаций одного из следующих генов кодирующих белки саркомера:
• β-тяжёлая цепь миозина, ген локализован в хромосоме 14;
• тропонин T сердечной ткани, ген в хромосоме 1;
• тропомиозин, ген в хромосоме 15;
• миозин-связывающий белок C, ген в хромосоме 11;
• лёгкие цепи миозина (хромосомы 3 и 12);
• актин (хромосома 15), титин, тропонин C.
Семейный характер патологии отмечают более чем у половины больных. При этом в одной семье имеются признаки одной и той же мутации. Выявлены по крайней мере 10 генетических локусов, ответственных за возникновение заболевания. В этих генах обнаружено более 100 мутаций, вызывающих гипертрофическую кардиомиопатию. Выживаемость больных гипертрофической кардиомиопатией, возникшей в результате особо клинически злокачественной мутации гена β-тяжёлой цепи миозина, существенно ниже, чем при мутации гена сердечного тропонина T, причём в последнем случае клинические проявления возникают в более позднем возрасте. Генетические исследования показывают, что у близких родственников больных нередко имеются те же генетические мутации, однако без неблагоприятных фенотипических признаков (здоровые носители мутировавщего гена). У этих лиц гипертрофия миокарда может развиться спустя много лет.
ПАТОГЕНЕЗ
Большинство мутаций генов саркомеров приводят к замене одной аминокислоты в белке, имеющем важное функциональное значение. В результате мутации генов возникает гипертрофия левого желудочка и участки дезорганизации кардиомиоцитов. Механизмы, приводящие к характерным изменениям, остаются неясными
Механизмы, приводящие к характерным изменениям, остаются неясными.
Возможные поражения миокарда
Основные кардиологические проявления тиреотоксикоза – это тахикардия, фибрилляция мышечных волокон предсердий, недостаточность сердечной деятельности, стенокардия на фоне обменных нарушений в миокарде. Избыток тиреоидных гормонов особенно опасен при наличии у пациента гипертонической или ишемической болезни, пороков сердца, так как при этих состояниях отмечается быстрое прогрессирование декомпенсации кровообращения.
Учащенное сердцебиение при щитовидке или тахикардия
Частый и наполненный пульс – это один из характерных признаков повышенной функции щитовидной железы. Обычно диагностируется синусовая тахикардия. Ее отличительным свойством является постоянство, в состоянии покоя и во время сна она не исчезает полностью.
Синусовая тахикардия при тиреотоксикозе
При малейшем волнении больные жалуются на интенсивное сердцебиение. А физическая нагрузка существенно не меняет ритм, так как главным фактором тахикардии является высокая чувствительность к стрессовым гормонам.
Тиреотоксическая кардиомиопатия
Причиной нарушения питания сердечной мышцы является дефицит энергии из-за повышенной потребности клеток миокарда при высокой нагрузке. Гормоны щитовидной железы приводят к потере запасов АТФ, накоплению в кардиомиоцитах жира с потерей их сократительной способности. Атрофические процессы сопровождаются усиленным синтезом соединительной ткани.
Кардиосклероз при тиреотоксикозе отличается быстрым формированием недостаточности кровообращения, особенно у пожилых пациентов, которая протекает преимущественно по правожелудочковому типу с отеками, увеличением печени и болями в области сердца.
Кардиомиопатия при тиреотоксикозе
Аритмия при щитовидной железе
Для тиреотоксической аритмии типичны предсердные формы, так как именно в этой области сосредоточено большинство адренорецепторов сердца. Желудочковые варианты дисритмии развиваются на поздних стадиях болезни или при сопутствующих кардиальных патологиях.
Вначале проявления носят эпизодический, приступообразный характер, по мере прогрессирования мерцательная аритмия становится рецидивирующей или постоянной. После успешного лечения щитовидной железы у молодых пациентов полностью восстанавливается синусовый ритм без дополнительного лечения.
Аритмия при тиреотоксикозе
Стенокардия при тиреотоксикозе
Интересной особенностью поражения сердца при гиперфункции щитовидной железы является отсутствие атеросклеротических изменений в сосудах. Это связано с тем, что тиреоидные гормоны снижают содержание холестерина в крови и способность к образованию на стенке сосудов бляшек. Ишемическая болезнь у таких пациентов может возникать только до начала тиреотоксикоза, который усиливает тяжесть ее течения.
Стенокардия при тиреотоксикозе
Тем не менее у больных могут быть типичные приступы стенокардии обменного происхождения. Это связано с относительной ишемией тканей сердца из-за постоянной напряженной работы и истощения компенсаторных резервов миокарда.
Смотрите на видео о тиреотоксикозе и его лечении:
Профилактика инфекционно-токсической кардиопатии
Профилактика инфекционно-токсической кардиопатии (ИТК) направлена на предотвращение возникновения и прогрессирования данного заболевания. В основе профилактических мер лежат меры для предотвращения инфекций и управления факторами, способствующими развитию токсического воздействия на сердце.
Основные меры профилактики ИТК включают:
Соблюдение гигиенических правил. Регулярное мытье рук с мылом и водой, использование антисептических средств помогает предотвратить распространение инфекций. Необходимо также избегать контакта с больными людьми, особенно в период эпидемий
Важно следить за чистотой и протирать поверхности в доме, рабочем месте и общественных местах.
Вакцинация. Прививки представляют собой эффективный способ профилактики инфекций, которые могут привести к ИТК
Вакцинация против гриппа, пневмококка, гепатита В и других инфекций может снизить риск развития ИТК.
Правильное применение антибиотиков. Использование антибиотиков должно быть ограничено только по назначению врача и с соблюдением рекомендованной длительности курса. Неправильное использование антибиотиков может привести к развитию сопротивляемости микроорганизмов и способствовать возникновению инфекций, которые могут вызвать ИТК.
Рациональное питание. Правильное питание, богатое питательными веществами, антиоксидантами и микроэлементами, может улучшить работу сердца и укрепить иммунную систему. Рекомендуется включать в рацион свежие фрукты, овощи, зелень, рыбу, морепродукты и отказаться от избытка животных жиров, соли и сахара.
Физическая активность. Регулярные физические нагрузки помогают поддерживать здоровье сердца и кровеносной системы. Рекомендуется заниматься спортом или физическими упражнениями в соответствии с рекомендациями врача.
Управление факторами риска. К факторам риска ИТК относятся курение, чрезмерное употребление алкоголя, нарушения обмена веществ, гипертония, диабет, ожирение и стресс. Необходимо избегать курения, контролировать уровень алкоголя, поддерживать здоровый уровень сахара в крови, следить за артериальным давлением, поддерживать нормальный вес и уметь справляться со стрессом.
Соблюдение этих мер поможет снизить риск развития инфекционно-токсической кардиопатии и поддерживать здоровье сердца.






























